- 印刷用
- 2018年5月25日
国立大学法人 筑波大学
EAファーマ株式会社
エーザイ株式会社
研究成果のポイント
-
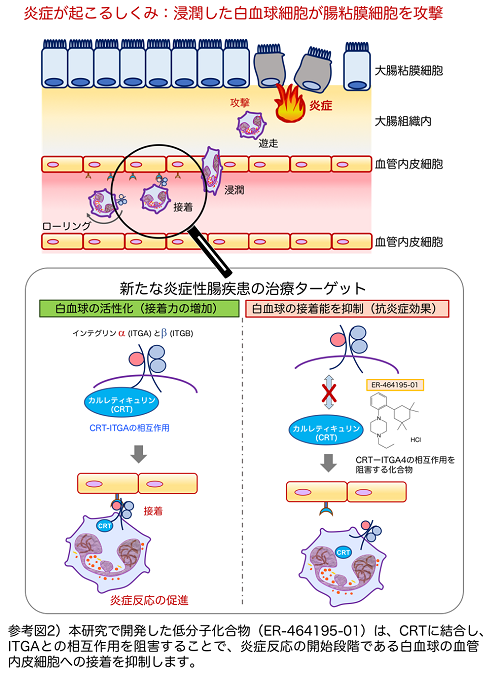
- 炎症性腸疾患(IBD)注1)治療薬として開発中の低分子化合物E6007の類縁体が、細胞内タンパク質のカルレティキュリン(CRT)注2)に結合し、白血球の接着分子インテグリン注3)との相互作用を阻害することで、白血球全般の接着・浸潤を抑制する新規の作用メカニズムを解明しました。
- 本類縁体をIBDモデルマウスに経口投与したところ、病変部位への白血球浸潤が抑制され、顕著な抗炎症効果を示しました。
- 解明された抗炎症作用メカニズムは、新たなIBD治療薬として提供を目指しているE6007の価値向上と開発の加速化につながることが期待されます。
国立大学法人筑波大学 生存ダイナミクス研究センター(TARA)の深水昭吉教授らの研究グループ、およびエーザイ株式会社(以下 エーザイ)と、その消化器事業子会社であるEAファーマ株式会社(以下 EAファーマ)は、エーザイが創出し、現在、EAファーマが治験中の炎症性腸疾患(IBD)治療薬E6007の類縁体(ER-464195-01)と、筑波大学が開発したタンパク質間相互作用可視化マーカーを用い、本類縁体が、CRTとインテグリンα4(ITGA4)の相互作用を遮断することにより、インテグリン活性化を阻害し、白血球全般の接着・浸潤を抑制するメカニズムを解明しました。
IBDは、腸管に原因不明の炎症を繰り返す難病の総称であり、潰瘍性大腸炎 (UC)とクローン病 (CD)に大別されます。本共同研究グループは、UCの大腸病変部位において、白血球の接着・浸潤に関与する「CRTとITGA4の相互作用」が増加すること、そして培養細胞を用いた検討から、このタンパク質間相互作用をER-464195-01が抑制することを見出しました。また、IBDモデルマウスへのER-464195-01の経口投与により、病変部位への白血球浸潤が抑制され、抗炎症作用が発揮されることを確認しました。加えて、IBDモデルマウスの大腸組織を用いたトランスクリプトーム解析注4)から、「正常−炎症−改善」の過程にプログラミングされる遺伝情報を明らかにしました。
近年、IBD患者数が増加の一途を辿る中、新規作用メカニズムを有し、有効性と服薬コンプライアンスに優れる経口投与可能な治療薬が求められています。この点において本共同研究成果は、新たなIBD治療方法の提供につながることが期待されます。
本研究成果は、2018年5月17日付「Nature Communications」電子版にて公開されました。
* 本研究は、国立研究開発法人科学技術振興機構(JST)が助成する産学共同実用化開発事業(NexTEP)・「低分子化合物とバイオマーカーを用いた炎症性腸疾患の治療」(研究代表者:深水昭吉、研究期間:平成26~32年度)によって実施されています。
(https://www.jst.go.jp/jitsuyoka/topics/saitaku_201403.html)
研究の背景
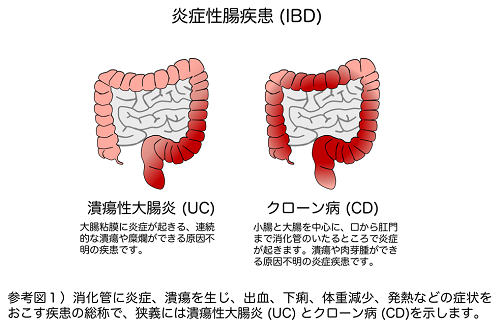
IBDは、大腸や小腸の粘膜に慢性的な炎症が起こる原因不明の疾患の総称であり、寛解と再燃を繰り返しながら長期間炎症が続くことで、大腸癌の原因にもなります(参考図1)。難病情報センター(http://www.nanbyou.or.jp)の平成25年度の調査では、若年者(20〜30代)が最も高発病率を示し、とりわけ、UCは166,060人、CDは39,799人と、難病の中でも患者数が多い疾患として報告されています。現在のところ、IBDの病変部位に種々の白血球の浸潤が認められていることに加え、接着分子であるITGA4が強く発現していることから、その治療には、白血球除去療法やITGA4に対する抗体治療薬が使用されています。しかしながら、IBD患者数は年々増加しており、服薬コンプライアンスと有効性に優れる低分子治療薬の開発が望まれています。
エーザイとEAファーマは、新たなIBD治療薬として、インテグリンの活性化阻害作用を有する低分子化合物E6007を開発中であり(参考文献1)、本共同研究グループは、このE6007の類縁体(ER-464195-01)を用い、筑波大学が開発した、タンパク質間の相互作用を可視化する技術(バイオマーカー)を活用して、抗炎症作用が発現するメカニズムの解明を試みました。
研究内容と成果
分子シャペロン注5)であるCRTは、インテグリンサブユニットと結合して細胞接着を促進します (参考文献2)。本共同研究グループは、UC患者の大腸組織とタンパク質間相互作用を検出するバイオマーカーを用いて、CRTとITGA4の相互作用を調べた結果、正常部位に比べて病変部位ではこの相互作用が有意に上昇していることを見出しました。そこで、CRTとITGA4の相互作用を遮断することにより、白血球細胞の活性化を抑制できるという仮説のもと、化合物ライブラリー(エーザイ)を用いたスクリーニング解析を行いました。その結果、CRTに結合し、ITGA4との相互作用を阻害することで、白血球接着を抑制する低分子化合物ER-464195-01を同定しました(参考図2)。
この化合物を予防的に経口投与したマウスでは、デキストラン硫酸ナトリウム(DSS)誘導性大腸炎に対して顕著な抗炎症効果を示すことに加え、RNAシークエンシング法による全転写物の網羅的解析から、炎症性サイトカインや炎症応答性シグナル因子の発現が有意に抑えられていることが明らかになりました。さらに、DSS誘導性大腸炎を起こしたマウスにER-464195-01を投与したところ、興味深いことに、粘膜細胞や粘膜バリアの障害注6)や炎症性細胞の浸潤が大きく改善されました。本共同研究を通じて解明された抗炎症作用メカニズムは、IBD治療の新たな選択肢の提供につながると期待されます。
今後の展開
本共同研究により解明された抗炎症効果を有する低分子化合物ER-464195-01は、現在治験中のE6007の類縁体であり、E6007も同様の作用メカニズムを有すると考えられます。これにより、E6007の価値向上と開発の加速化が期待されます。
参考図
用語解説
注1) 炎症性腸疾患 (Inflammatory Bowel Disease, IBD)
潰瘍性大腸炎 (UC) とクローン病 (CD)を指し、大腸粘膜に潰瘍やびらんが生じ、出血・下痢・体重減少・発熱などの症状を起こす原因不明の慢性炎症性疾患です。
注2) カルレティキュリン (Calreticulin, CRT)
小胞体に存在する、カルシウムイオン(Calcium ion、Ca2+)結合性の分子シャペロンです。細胞内では、細胞接着やカルシウムイオンの恒常性、細胞間の情報伝達、遺伝子発現、糖タンパク質の合成など、多彩な生理機能を有するタンパク質です。
注3) インテグリン (Integrin)
接着分子(タンパク質)であるインテグリンは、α鎖とβ鎖のヘテロダイマー(サブユニット)で構成され、18種類のα鎖と8種類のβ鎖の組み合わせから、24種類が知られています。CRTは、インテグリンα鎖サブユニットの細胞内側のアミノ酸配列に結合(相互作用)します。
注4) トランスクリプトーム解析 (Transcriptome analysis)
トランスクリプトームは、細胞中に存在する全mRNA(メッセンジャーRNA)の総体を指します。近年の次世代シークエンサー技術の発展により、遺伝子の配列や発現の解析が加速化されるようになりました。中でも、RNAシークエンシング法の進展によって、大量のRNA配列情報の迅速な解析が可能になりました。
注5) 分子シャペロン (Molecular chaperon)
細胞内のタンパク質は、立体構造に折りたたまれています(フォールディング)。分子シャペロンは、種々のタンパク質が機能を獲得できるようにフォールディングを調節するタンパク質です。
注6) 粘膜バリア障害 (Mucosal barrier injury)
腸管粘膜バリア(壁)は、腸管上皮によって形成されており、病原体や有害物質、口から取り込まれたウイルスなどが、腸壁から体内に吸収されないようにブロックする機能を持っています。腸管粘膜に強い炎症が生じると、粘膜細胞が損傷し、腸管粘膜バリアの障害が起こります。
参考文献
1) エーザイ株式会社・国立大学法人筑波大学 2014年5月7日付プレスリリース
(https://www.eisai.co.jp/news/news201420.html)
2) Coppolino MG, et al. Nature 386,843-847,1997
掲載論文
【題 名】Calreticulin and integrin alpha dissociation induces anti-inflammatory programming in animal models of inflammatory bowel disease.
(炎症性腸疾モデル動物における、カルレティキュリン-インテグリン相互作用の抑制は、抗炎症プログラミングを誘導する)
【著者名】Masayoshi Ohkuro†, Jun-Dal Kim†, Yoshikazu Kuboi, Yuki Hayashi, Hayase Mizukami, Hiroko Kobayashi-Kuramochi, Kenzo Muramoto, Manabu Shirato, Fumiko Michikawa-Tanaka, Jun Moriya, Teruya Kozaki, Kazuma Takase, Kenichi Chiba, Kishan Lal Agarwala, Takayuki Kimura, Makoto Kotake, Tetsuya Kawahara, Naoki Yoneda, Shinsuke Hirota, Hiroshi Azuma, Nobuko Ozasa-Komura, Yoshiaki Ohashi, Masafumi Muratani, Keiji Kimura, Ieharu Hishinuma and Akiyoshi Fukamizu*
† These two authors contributed equally to this work
* Corresponding author
【掲載誌】Nature Communications 9, 1982 (2018), doi:10.1038/s41467-018-04420-4
問合わせ先
-
筑波大学
広報室
Email: kohositu@un.tsukuba.ac.jp
TEL:029-853-2039
-
EAファーマ株式会社
経営企画部
TEL:03-6280-9802
-
エーザイ株式会社
PR部
TEL:03-3817-5120
