- 印刷用
- 2012年5月28日
エーザイ株式会社(本社:東京、社長:内藤晴夫)は、英国子会社であるエーザイ・ヨーロッパ・リミテッドが、AMPA受容体拮抗剤「FycompaTM」(一般名:ペランパネル)について、12歳以上のてんかん患者様の部分発作(二次性全般化発作を含む)に対する併用療法としての承認勧告(positive opinion)を、欧州医薬品庁(European Medicines Agency:EMA)の医薬品委員会(Committee for Medicinal Products for Human Use:CHMP)より受領したと、発表しました。
ペランパネルは、当社が創製した、高選択的、非競合AMPA型グルタミン酸受容体拮抗剤であり、本剤が承認されれば、世界で始めての当該作用機序による、抗てんかん剤となります。
今回のCHMPの判断は、計1,480人の部分てんかん患者様を対象にした、3つの申請用臨床第Ⅲ相試験の結果に基づいています。これらの試験は、いずれもグローバル、無作為化、二重盲検、プラセボ対照、投与量漸増試験として実施され、すべての試験において、二次性全般化を含む部分てんかん発作に対する併用療法として、一貫して優れた有用性を示しました。なお、主な有害事象として、めまい、頭痛、眠気、神経過敏、けん怠感、転倒、および運動失調が報告されています。今回のCHMPの承認勧告には、成人とともに12歳以上の青年期の患者様への適応も含まれており、幅広い患者様層への貢献が期待されます。また、1日1回の経口投与であることから、てんかん患者様の服薬時の負担の軽減と服薬コンプライアンスの向上が期待されます。CHMPによる今回の承認勧告により、本剤について3ヵ月以内に、EMAからの承認が見込まれます。
当社は、てんかん領域を重点疾患領域のひとつに位置づけており、本領域において複数の治療選択肢を提供することで、てんかん患者様とそのご家族の多様なニーズの充足とベネフィット向上に取り組んでまいります。
以上
[参考資料として、てんかん、てんかんとAMPA受容体阻害、ペランパネルの臨床第Ⅲ相試験、エーザイのてんかん領域での取り組みについて添付しています]
<参考資料>
1. てんかんについて
てんかんは、様々な精神機能・身体機能に影響を及ぼす発作が生じる疾患です。ある患者様に2つ以上の非誘発性発作が生じると、てんかんとされています。発作は、一時的に過剰な電気的興奮が起こることによって、生じるものです。てんかん発作には、けいれんや意識消失、そして発作として認識されにくいblank stare(ぼうっと一点を見つめる)、唇鳴らし、手足の痙動など、様々な症状が伴います。
また、てんかんは年齢を問わずに発症し、一生のある時期に0.5%~2%の人がてんかんを発症すると言われています。てんかんの患者様数は、日本が100万人、欧州(G5)が240万人、米国が300万人、世界中で5000万人超と報告されています。欧州では、現在、治療を受けている部分てんかん患者様の最大3分の1が、てんかんの発作をコントロールできていないと報告されており、いまだアンメット・メディカル・ニーズが高い疾患となっています。
2. AMPA受容体拮抗剤「FycompaTM」(ペランパネル)について
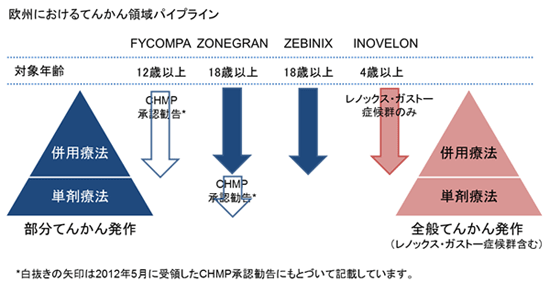
「FycompaTM」(ペランパネル)は、当社が創製した新規化合物であり、AMPA受容体に対して高選択非競合的な拮抗剤です。本剤は、シナプス後AMPA受容体のグルタミン酸による活性化を阻害し、神経の過興奮を抑制することで、抗てんかん作用を発揮すると考えられています。本剤は、部分てんかんを対象とした臨床第Ⅱ相および第Ⅲ相試験において、幅広い発作抑制効果が示されています。本剤は、部分てんかんの治療剤(一日一回、経口投与)として、欧州ではCHMPより承認勧告を受領、米国では承認申請が審査中、および日本では第Ⅲ相試験の段階にあります。また、さらなる適応の拡大をめざし、全般てんかんについて国際共同治験として第Ⅲ相試験を実施しており、部分てんかん単剤療法、レノックス・ガストー症候群などを対象とした臨床試験が計画されています。
3. ペランパネルの臨床第Ⅲ相試験について
ペランパネルの申請用試験は3つの臨床第Ⅲ相試験(304、305、および306試験)から成り、計1,480人の青年期を含む12歳以上の部分てんかん患者様が本試験に参加されました。306試験は、最小有効量を把握することを主目的として、「プラセボ、2mg、4mg、8mg」の4群で実施されました。また、304試験と305試験は、投与量範囲の決定を主目的とし、「プラセボ、8mg、12mg」の3群で実施されました。
いずれの試験も、グローバル、無作為化、プラセボ対照、二重盲検、並行群間比較、用量漸増試験として実施され、「部分発作回数変化率(percentage change in seizure frequency)」、「50%レスポンダーレート(50% responder rate、部分発作回数が観察期間と比べて50%以上改善した症例の割合)」、「複雑部分発作および二次性全般化発作減少率(percentage reduction of complex partial plus secondarily generalized seizures)」、および「用量反応性(evaluation for dose response)」を評価項目としていました。また、EMAの主要評価項目には「50%レスポンダーレート」が、米国FDAの主要評価項目には「部分発作回数変化率(中央値)」が設定されました。各試験の全症例を対象とした結果は下記の通りです。
1)306試験
- 「50%レスポンダーレート」:プラセボ投与群の17.9%に対し、ペランパネルの2mg投与群で20.6%(p=0.4863)、4mg投与群で28.5%(p=0.0132)、8mg投与群で34.9%(p=0.0003)
- 「発作回数変化率(中央値)」:プラセボ投与群の-10.7%に対し、ペランパネルの2mg投与群で-13.6%(p=0.4197)、4mg投与群で-23.3%(p=0.0026)、8mg投与群で-30.8%(p<0.0001)
- 「主な有害事象」:めまい、頭痛、眠気
2)305試験
- 「50%レスポンダーレート」:プラセボ投与群の14.7%に対し、ペランパネルの8mg投与群で33.3%(p=0.0018)、12mg投与群で33.9%(p=0.0006)
- 「発作回数変化率(中央値)」:プラセボ投与群の-9.7%に対して、ペランパネルの8mg投与群で-30.5%(p=0.0008)、12mg投与群で-17.6%(p=0.0105)
- 「主な有害事象」:めまい、けん怠感、頭痛、眠気
3)304試験
- 「50%レスポンダーレート」:プラセボ投与群の26.4%に対し、ペランパネルの8mg投与群で37.6%(p=0.0760)、12mg投与群で36.1%(p=0.0914)
- 「発作回数変化率(中央値)」:プラセボ投与群の-21.0%に対して、ペランパネルの8mg投与群で-26.3%(p=0.0261)、12mg投与群で-34.5%(p=0.0158)
- 「主な有害事象」:めまい、眠気、神経過敏、頭痛、転倒、運動失調
4. エーザイのてんかん領域での取り組みについて
エーザイは、てんかん領域を重点疾患領域と位置づけ、AMPA受容体拮抗剤「ペランパネル」の開発を進めるだけでなく、既に成人部分てんかん併用療法として「Zonegran®」(創製・ライセンス元:大日本住友製薬、Na/Caチャネル阻害等に基づく抗てんかん剤:欧州、米国、アジア)、「Zebinix®」(同:BIAL-Portela&Ca社、電位依存性Naチャネル阻害に基づく抗てんかん剤:欧州)をまた小児の早期から発症する重篤なてんかんであるレノックス・ガストー症候群の併用療法として「Inovelon®/BANZEL®」(同:Novartis社、Naチャネル阻害作用に基づく新規トリアゾール骨格の抗てんかん剤:欧州、アジア/北米)を販売しています。また、2012年5月に、欧州において「Zonegran®」による部分てんかん単剤療法に関し、CHMPより承認勧告を受領しました。