- 研究開発
- 製品情報
- 印刷用
- 2024年7月31日
エーザイ株式会社
バイオジェン・インク
エーザイ株式会社(本社:東京都、代表執行役CEO:内藤晴夫、以下 エーザイ)とバイオジェン・インク(Nasdaq:BIIB、本社:米国マサチューセッツ州ケンブリッジ、CEO:Christopher A. Viehbacher、以下 バイオジェン)は、このたび、米国フィラデルフィアおよびバーチャルで開催中のアルツハイマー病協会国際会議(Alzheimer's Association International Conference:AAIC)2024において、抗Aβプロトフィブリル*抗体であるレカネマブ(一般名、製品名「レケンビ®」)に関する最新データを発表したことをお知らせします。レカネマブは、プラークの速やかな除去作用に加え、プラーク除去後も引き続き神経細胞傷害や神経細胞死を起こす毒性の高いプロトフィブリルを選択的に取り除く、デュアル アクションを有する唯一の早期AD治療薬です。本発表資料は、エーザイのコーポレートサイトのIRセクションよりご覧いただけます。
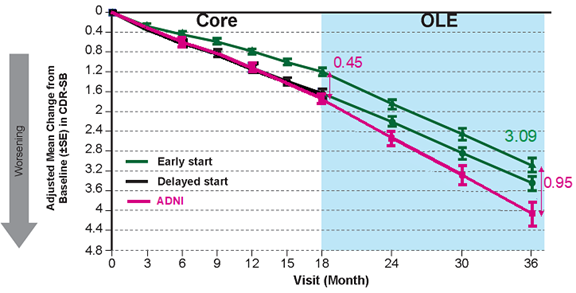
3年間の継続的なレカネマブ治療により、CDR-SBによる臨床症状の悪化が-0.95減少し、個々の早期AD当事者様にとって臨床的に意義のある継続的なベネフィットが示される
Clarity AD試験は、早期アルツハイマー病(AD)当事者様1,795人(レカネマブ群:10 mg/kg bi-weekly静注投与:898人、プラセボ群:897人)を対象とした、プラセボ対照、二重盲検、並行群間比較、無作為化グローバル臨床第Ⅲ相試験です。18カ月間の本コア試験を完了した被験者の95%が、コア試験に続く非盲検長期継続投与試験(OLE)に参加することを選択しました。コア試験において、主要評価項目である全般臨床症状の評価指標CDR-SBのレカネマブ群とプラセボ群のベースラインからの平均変化量の差は、 -0.45(P=0.00005)でした。コア試験とOLEを通して3年間のレカネマブ投与を受けた被験者のCDR-SBのベースラインからの平均変化量の差は、ADNI**(Alzheimer’s Disease Neuroimaging Initiative)データを基にしたADの自然経過による低下と比較して-0.95まで拡大しました1。CDRスコアにおいて、記憶、地域社会活動、家庭および趣味に関する項目が0.5から1へ変化(悪化)するということは、当事者様が自立して最近の出来事を記憶し、日常生活や家事を行い、趣味や知的関心事を楽しむといった能力が、軽度障害の段階から自立した活動が難しくなる段階へ移行することを意味します。2,3
安全性
レカネマブの3年間の継続治療において新たな安全性の兆候は観察されませんでした。アミロイド関連画像異常(ARIA)の殆どは治療開始後6カ月以内に発現し、その後のARIA発現率は低く、プラセボと同様でした。また、ARIAを発現した殆どの当事者様は、発現後にCDR-SBによる評価を受けており、感度分析の結果、ARIA発現は認知機能や日常生活機能に影響を与えないことが示されました。このことから、ARIAの発現と長期的な疾患進行の加速とは関連がないことが確認されました。FDAの添付文書に記載されているように、ARIAの発現率と時期は治療法によって異なります4。
ADのより初期段階で治療を開始した当事者様の50%以上が3年間のレカネマブによる治療後も引き続き改善を示した
Clarity AD試験では、任意のタウPETサブスタディとして、タウPETプローブMK6240を用い、脳内にタウ蓄積がないもしくは少ない(No tau/Low tau)当事者様を特定しました。タウが脳内の記憶中枢に蓄積し始めると、認知機能や日常生活機能の低下が始まるため、No tau/Low tau当事者様は、ADの最も初期段階にあると考えられます。3年間のレカネマブによる治療後、CDR-SBについて、No tau/Low tau当事者様の59%(41人中24人)で改善あるいは維持が示され、51%(41人中21人)で改善が認められました。
主に記憶を評価するスケールであるADAS-Cog14では、当事者様の63%で改善あるいは維持が示され、61%で改善が認められました。当事者様の日常生活動作を評価するスケールであるADCS MCI-ADLでは、当事者様の63%に改善あるいは維持が示され、59%で改善が認められました。これらのことから、より早期にレカネマブによる治療を開始することにより、病態進行に大きいポジティブな影響を与え、早期AD当事者様に長期にわたる持続的なベネフィットを提供する可能性が示唆されました1。
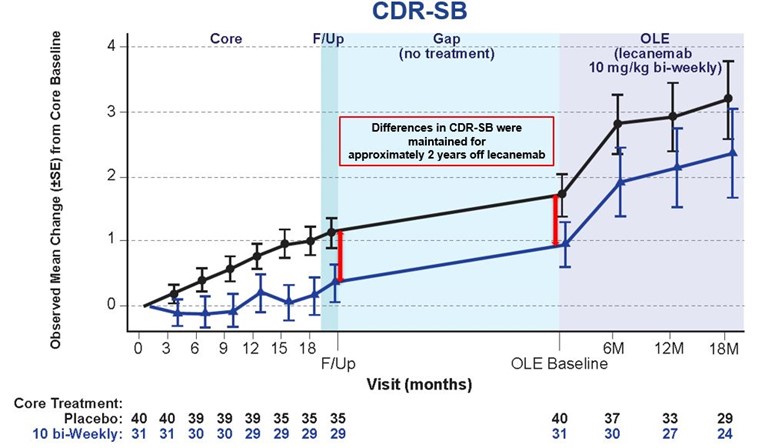
プラーク除去後も、治療を中止するとADの病態は進行し続ける
201試験は、早期ADの856人を対象として実施された多施設共同、二重盲検、プラセボ対照、臨床第Ⅱb相試験です。18カ月のコア試験の後、9〜59カ月の無投与期間(ギャップ期間、平均24カ月)を経て、適格な当事者様がOLEに参加しました。ギャップ期間中、コア試験でレカネマブ投与を受けた当事者様のCDR-SBで測定される臨床効果(プラセボ投与群との差)は維持されましたが、悪化の速度(傾き)はプラセボ投与群と同等に戻ることが確認されました。このことは、プラークが除去されてもADは進行し続け、治療を中止すると悪化の速度がプラセボと同じ速度に戻ることを示しています1。
プラーク除去後も、デュアル アクションを有するレカネマブは治療期間中のバイオマーカー上のベネフィットは継続する
主要なAD関連の体液バイオマーカーである血漿中のAβ42/40比、p-tau181、p-tau217、GFAP(glial fibrillary acidic protein)***は、アミロイドPETよりもアミロイドおよびタウによるAD病理の進行に対する感度の高い指標であり、レカネマブの治療を中止するとより速くAD病理の再蓄積を示しました。201試験、Clarity AD試験ならびにそれぞれのOLEデータを用いたモデリングから、血漿中のAβ42/40比、p-tau181、GFAPが治療効果の半分が失われるまでの期間(治療前レベルの50%まで再蓄積する期間)はそれぞれ0.5年、1.6年、1.7年と短期間である一方、プラークは12.1年と緩徐であることが示されました。
201試験のOLEでは、ギャップ期間後のレカネマブ治療の再開により、血漿中のAβ42/40比、p-tau181、p-tau217、GFAPに改善が見られました。これらの結果は、プラークを除去しても治療を中止するとADの病態は進行し続けることを示しています。レカネマブは、アミロイド病理の指標である体液バイオマーカーの改善を維持することから、当事者様はレカネマブによる治療を継続することで持続的なベネフィットを受けることができます。
プロトフィブリルとプラークに作用するレカネマブのデュアル アクションは、アミロイドに作用しタウ伝播を遅延させ、慢性進行性疾患であるADに対する長期継続治療を提供する
レカネマブは、アミロイドプラークに加え、神経毒性の高いプロトフィブリルを選択的にターゲットとするデュアル アクションを有する唯一の早期AD治療薬です。プロトフィブリルはADの初期段階から脳内に蓄積し、神経細胞機能の喪失や異常、炎症、記憶障害を引き起こします。非臨床研究において、抗プロトフィブリル抗体は、プロトフィブリルによる神経機能障害と記憶障害を防ぐことを示しました5。レカネマブは、毒性の高いプロトフィブリルに最も高い親和性を以て、優先的に結合します。レカネマブは、脳内にあるプラークとプロトフィブリルを速やかに除去した後、その後も生成され神経障害を引き起こし続けるプロトフィブリルを継続的に除去します。また、プロトフィブリルはタウ伝播にも関与しています5。タウPETサブスタディでは、継続的なレカネマブ治療は、タウPETで測定されるあらゆる脳領域のタウ蓄積の増加を遅らせました6。脳脊髄液中のMTBR-tau243はタウPETと相関が高いバイオマーカーであり、ADの病態の進行に伴って増加しますが、レカネマブの投与により増加率の減少が観察されました。さらに、レカネマブは、p-tau217および神経炎症や神経変性に関連するその他のバイオマーカーについても改善しました。これらの結果は、タウの病態生理に対するレカネマブの疾患修飾効果の可能性を示唆しています7。
レカネマブは、エーザイが開発および薬事申請をグローバルに主導し、エーザイの最終意思決定権のもとで、エーザイとバイオジェンが共同商業化・共同販促を行います。
* プロトフィブリルは、ADによる脳損傷に寄与し、この進行性の深刻な疾患の認知機能低下に主な役割を果たす、最も毒性が高いAβ種であると考えられています。プロトフィブリルは脳内の神経細胞の損傷を引き起こし、その結果、複数のメカニズムを介して認知機能に悪影響を及ぼす可能性があります1。そのメカニズムとして、不溶性アミロイドプラークの発生を増加させるだけでなく、神経細胞やその他の細胞間のシグナル伝達に直接的な損傷を起こすことも報告されています。プロトフィブリルを減らすことで、神経細胞への損傷や認知機能障害を軽減させ、ADの進行を防ぐ可能性があると考えられています8。
** ADNIは、ADの発症を予測し、治療の有効性を確認する方法を開発するために2005年に開始された臨床研究プロジェクトです。ADNI観察コホートは、Clarity AD試験当事者様と同等な集団です。Clarity AD試験被験者様と同じ背景を有するADNI参加者は、Clarity AD試験の18カ月のコア試験におけるプラセボ群と同程度の病態の進行を示しました。
*** GFAP(glial fibrillary acidic protein)は、アストログリアの活性化のマーカーであり、ADのバイオマーカーと考えられています。GFAPの発現はAβプラーク密度と相関し、CSF濃度は症状の進行に伴い上昇します。
以上
本件に関する報道関係お問い合わせ先
-
エーザイ株式会社
PR部
TEL:03-3817-5120
-
バイオジェン・インク
パブリック アフェアーズ
<参考資料>
- 1. レケンビについて
「レケンビ」(一般名:レカネマブ、米国ブランド名:「LEQEMBI®」)は、BioArctic AB(本社:スウェーデン、以下 バイオアークティック)とエーザイの共同研究から得られた、アミロイドベータ(Aβ)の可溶性(プロトフィブリル)および不溶性凝集体に対するヒト化IgG1モノクローナル抗体です。
レカネマブの承認は、エーザイが実施した大規模グローバル臨床第Ⅲ相試験であるClarity AD試験のデータに基づくものであり、本試験においてレカネマブは主要評価項目ならびに全ての重要な副次評価項目を統計学的に有意な結果をもって達成しました9,10。主要評価項目は、全般臨床症状の評価指標であるCDR-SB(Clinical Dementia Rating Sum of Boxes)であり、レカネマブはCDR-SBにおける18カ月時点の臨床症状の悪化をプラセボと比較して27%抑制しました。また、副次評価項目の一つである、衣服の着脱、食事、地域活動への参加など当事者様が自立して生活する能力を介護者が評価するAD Cooperative Study-Activities of Daily Living Scale for Mild Cognitive Impairment(ADCS MCI-ADL)においては、プラセボと比較して37%の統計学的に有意なベネフィットが認められました。なお、レカネマブ投与群で最も多かった有害事象(10%以上)は、Infusion reaction、ARIA-H(ARIAによる脳微小出血、脳出血、脳表ヘモジデリン沈着)、ARIA-E(浮腫/浸出)、頭痛および転倒でした。
レカネマブは、ADによる軽度認知障害または軽度認知症に係る適応で、米国、日本、中国、韓国、香港、イスラエルで承認を取得しており、12の国と地域で承認申請を行っています。また、2024年3月に静注維持投与に関する米国食品医薬品局(FDA)への生物製剤承認一部変更申請(sBLA)を提出し、2024年6月、受理されました。2024年5月に、利便性向上をめざし開発を進めている皮下注射(SC)製剤について、米国FDAに、Fast Track指定の下、維持投与に関する生物製剤承認申請の段階的申請を開始しました。
2020年7月から、臨床症状は正常で、ADのより早期ステージにあたる脳内Aβ蓄積が境界域レベルおよび陽性レベルのプレクリニカルADを対象とした臨床第Ⅲ相試験(AHEAD 3-45試験)を米国のADおよび関連する認知症の学術的臨床試験のための基盤を提供するAlzheimer's Clinical Trials Consortium(ACTC)とのパブリック・プライベート・パートナーシップ(PPP)で行っています。ACTCは、National Institutes of Health傘下のNational Institute on Agingによる資金提供を受けています。また、2022年1月から、セントルイス・ワシントン大学医学部(米国ミズーリ州セントルイス)が主導する優性遺伝アルツハイマーネットワーク試験ユニット(Dominantly Inherited Alzheimer Network Trials Unit、以下 DIAN-TU)が実施する優性遺伝アルツハイマー病(DIAD)に対する臨床試験(Tau NexGen試験)が進行中です。本試験において、レカネマブは抗Aβ療法による基礎療法として選定されました。
- 2. エーザイとバイオジェンによるAD領域の提携について
エーザイとバイオジェンは、AD治療剤の共同開発・共同販売に関する提携を2014年から行っています。レカネマブについて、エーザイは、開発および薬事申請をグローバルに主導し、エーザイの最終意思決定権のもとで、エーザイとバイオジェンが共同商業化・共同販促を行います。
- 3. エーザイとバイオアークティックによるAD領域の提携について
2005年以来、エーザイとバイオアークティックはAD治療剤の開発と商業化に関して長期的な協力関係を築いてきました。エーザイは、レカネマブについて、2007年12月にバイオアークティックとのライセンス契約により、全世界におけるADを対象とした研究・開発・製造・販売に関する権利を取得しています。2015年5月にレカネマブのバックアップ抗体の開発・商業化契約を締結しました。
- 4. エーザイ株式会社について
エーザイ株式会社は、患者様と生活者の皆様の喜怒哀楽を第一義に考え、そのベネフィット向上に貢献する「ヒューマン・ヘルスケア(hhc)」を企業理念とし、この理念のもと、人々の「健康憂慮の解消」や「医療較差の是正」という社会善を効率的に実現することをめざしています。グローバルな研究開発・生産・販売拠点ネットワークを持ち、戦略的重要領域と位置づける「神経領域」「がん領域」を中心とするアンメット・メディカル・ニーズの高い疾患をターゲットに革新的な新薬の創出と提供に取り組んでいます。
また、当社は、国連の持続可能な開発目標(SDGs)のターゲット(3.3)である「顧みられない熱帯病(NTDs)」の制圧に向けた活動に世界のパートナーと連携して積極的に取り組んでいます。
エーザイ株式会社の詳細情報は、https://www.eisai.co.jpをご覧ください。SNSアカウントX、LinkedIn、Facebookでも情報公開しています。
- 5. バイオジェン・インクについて
1978年の創立以来、バイオジェンは世界をリードするバイオテクノロジー企業で、患者さんの人生を変革し、株主や私たちのコミュニティに価値をもたらす新薬をお届けするために革新的なサイエンスを開拓しています。私たちは優れた治療アウトカムをもたらすファースト・イン・クラスの治療薬や治療法を推進するために、人類の生物学に対する深い理解を応用し、異なるモダリティを活用します。私たちは長期的な成長をもたらすために投資利益率のバランスを考慮した上で、果敢にリスクを取るというアプローチを採択しています。
バイオジェンに関する情報については、https://www.biogen.com/ およびSNS媒体X、LinkedIn、Facebook、YouTubeをご覧ください。
Biogen Safe Harbor
This news release contains forward-looking statements, about the potential clinical effects of LEQEMBI; the potential benefits, safety and efficacy of LEQEMBI; potential regulatory discussions, submissions and approvals and the timing thereof; the treatment of Alzheimer's disease; the anticipated benefits and potential of Biogen's collaboration arrangements with Eisai; the potential of Biogen's commercial business and pipeline programs, including lecanemab; and risks and uncertainties associated with drug development and commercialization. These statements may be identified by words such as "aim," "anticipate," "believe," "could," "estimate," "expect," "forecast," "intend," "may," "plan," "possible," "potential," "will," "would" and other words and terms of similar meaning. Drug development and commercialization involve a high degree of risk, and only a small number of research and development programs result in commercialization of a product. Results in early-stage clinical studies may not be indicative of full results or results from later stage or larger scale clinical studies and do not ensure regulatory approval. You should not place undue reliance on these statements.
These statements involve risks and uncertainties that could cause actual results to differ materially from those reflected in such statements, including without limitation unexpected concerns that may arise from additional data, analysis or results obtained during clinical studies; the occurrence of adverse safety events; risks of unexpected costs or delays; the risk of other unexpected hurdles; regulatory submissions may take longer or be more difficult to complete than expected; regulatory authorities may require additional information or further studies, or may fail or refuse to approve or may delay approval of Biogen's drug candidates, including lecanemab; actual timing and content of submissions to and decisions made by the regulatory authorities regarding lecanemab; uncertainty of success in the development and potential commercialization of lecanemab; failure to protect and enforce Biogen's data, intellectual property and other proprietary rights and uncertainties relating to intellectual property claims and challenges; product liability claims; and third party collaboration risks;, results of operations and financial condition. The foregoing sets forth many, but not all, of the factors that could cause actual results to differ from Biogen's expectations in any forward-looking statement. Investors should consider this cautionary statement as well as the risk factors identified in Biogen's most recent annual or quarterly report and in other reports Biogen has filed with the U.S. Securities and Exchange Commission. These statements speak only as of the date of this news release. Biogen does not undertake any obligation to publicly update any forward-looking statements.
参考文献
- Sperling, R., Selkoe, D., Reyderman, L., Youfang, C., Van Dyck, C. (2024, July 28 - August 1). Does the Current Evidence Base Support Lecanemab Continued Dosing for Early Alzheimer’s Disease? [Perspectives Session] Alzheimer's Association International Conference, Philadelphia, PA, United States.
- Cohen S., et al. J Prev Alzheimers Dis.2022;9(3):507-522.
- Morris JC. Neurology. 1993;43(11):2412-4
- LEQEMBI® (lecanemab-irmb) [package insert]. Nutley, NJ. Eisai Inc.; 2023.
- Amin L, Harris DA. Aβ receptors specifically recognize molecular features displayed by fibril ends and neurotoxic oligomers. Nat Commun. 2021;12:3451. doi:10.1038/s41467-021-23507-z
- Willis, B., Charil, A., Fox, N., Teunissen, C., (2024, July 28-August 1). Beyond Amyloid Removal with Lecanemab Treatment: Update on Long-Term Fluid Biomarkers. [Featured Research Session] Alzheimer’s Association International Conference, Philadelphia, PA, United States
- Wildsmith, K., Pallavi, S., Horie, K., Reyderman, K., Charil, A., Kanekivo, M., Yin, H., Li, D., Koyama, A., Dhadda, S. Irizarry, M., Kramer, L. (2024, July 28-August 1). Lecanemab Slows Amyloid-Induced Tau Pathology as Supported by CSF MTBR-tau243 in Clarity AD. [Developing Topic] Alzheimer’s Association International Conference, Philadelphia, PA, United States
- Ono K, Tsuji M. Protofibrils of Amyloid-β are Important Targets of a Disease-Modifying Approach for Alzheimer's Disease. Int J Mol Sci. 2020;21(3):952. doi: 10.3390/ijms21030952. PMID: 32023927; PMCID: PMC7037706.
- Eisai presents full results of lecanemab Phase 3 confirmatory Clarity AD study for early Alzheimer's disease at Clinical Trials on Alzheimer's Disease (CTAD) conference. Available at: https://www.eisai.co.jp/news/2022/news202285.html
- van Dyck. C, et al. Lecanemab in Early Alzheimer’s Disease. The New England Journal of Medicine. DOI: 10.1056/NEJMoa2212948. https://www.nejm.org/doi/full/10.1056/NEJMoa2212948
