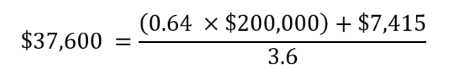- 企業情報
- 製品情報
- 印刷用
- 2023年1月7日
当社は、企業理念であるhhcコンセプトに則り、アルツハイマー病(AD)に関する当事者様の健康アウトカムの改善とQOL(Quality of Life)の向上、診断・治療・ケアプロセスの簡略化、医療システムの効率化への貢献、将来のADに関する投資を拡大すべく取り組んでいます。当社は、このたび米国において早期AD治療薬として迅速承認を取得したLEQEMBI™について、AD当事者様の本剤へのアクセスに影響を与える可能性のある「価値評価」と「価格設定」にあたり、当事者様、ご家族、介護者、医療提供者、支払者、社員、株主の全てのステークホルダーの価値を最大化すべく、包括的なアプローチを用いています。このアプローチには、「臨床的価値」としての薬剤の効果、「社会的価値」としての当事者様とご家族、介護者にもたらすベネフィットや、当事者様と介護者のQOLや生産性の向上に関する評価も含まれます。さらに、「経済的価値」として医療サービスの需要や包括的な疾病負担の軽減に対する影響についても評価するとともに、AD領域におけるイノベーションの推進も追求します。
米国におけるADの社会的影響
アルツハイマー病協会によると、2022年には、65歳以上の米国人のうち650万人がADによる認知症(軽度、中等度、高度のAD)であると推定されています1。ADは、2019年に米国における死因の第6位、2020年、2021年には死因の第7位となっており、慢性かつ進行性で心身に障害を引き起こす致死性疾患です。アルツハイマー病協会の別の報告書2によると、ADの進行を遅延する治療法が存在しない場合、米国における全支払者(メディケア、メディケイド、自己負担、その他の支払者)による医療費総額は、2020年の2,670億ドルから2030年には4,510億ドルに増加するとされています。
2022年の研究3では、米国人の1,000万人から1,400万人がMCI(Mild Cognitive Impairment;軽度認知障害)とされ、そのうち55%の方はADの病理を有するMCIと推定されています。本研究では、MCIから軽度認知症、軽度認知症から中等度認知症への進行を30%遅らせる治療薬が開発されれば、米国において1人当たり134,418ドルの生涯価値をもたらすと推定しています。
LEQEMBIが米国社会へもたらす価値
LEQEMBIはADの治療薬であり、臨床試験と同様、Aβ病理が確認されたADによる軽度認知障害または軽度ADの当事者様(早期ADと総称)において治療を開始する必要があります。米国におけるAD疾患修飾薬(AD-DMT:AD Disease Modifying Therapy)の投与対象として診断される早期AD当事者様は、3年後には約10万人と想定され、血液バイオマーカーなどの侵襲性の低い新しいスクリーニングや診断技術の今後の進歩を考慮すると、中長期的に徐々に増加していくと予測しています。
査読学術誌4に掲載された早期ADを対象とした臨床第Ⅲ相Clarity AD検証試験の結果、LEQEMBI投与は、投与18カ月時点における認知機能・全般症状の評価項目について、プラセボに対して悪化抑制を示す(18カ月の治療でCDR-SB*において27%の進行抑制など)一方、有害事象は想定の範囲内でした。本試験の結果は、FDAによる迅速承認の根拠となった後期臨床第Ⅱ相試験(201試験5)の結果と一貫しており、フル承認に向けた申請を間もなくFDAに提出する予定です。
臨床データより、LEQEMBIは当事者様の認知機能、日常生活動作、全般機能をより長く維持することが示され、当事者様とそのご家族にインパクトのある結果をもたらす可能性があります。臨床試験の被験者様の背景と結果をもとに、ADにおける個人レベルの認知機能低下の経過を予測し、早期介入の効果をシミュレーションする疾患モデル(AD Archimedes Condition Event simulation:AD ACEモデル6,7,8)を用いた研究により、LEQEMBIがもたらす可能性のある早期AD当事者様の生涯価値と潜在的経済効果を評価しました。LEQEMBIの201試験に基づく本シミュレーション研究結果は査読学術誌に掲載9,10され、Clarity AD試験のデータを用いた評価でも一貫した結果が示されました。
AD ACEモデルによるLEQEMBIの米国における当事者様一人当たりの社会的価値は年間37,600ドル
Clarity AD試験のデータを用いた最新のAD ACEシミュレーション研究では、LEQEMBIによる治療は、疾患の進行を遅らせ、その結果、早期ADに留まる期間を延長し、より進行した状態の期間を短くすることが予測されました。LEQEMBIの投与は、標準治療(SOC:Standard of Care)と比較して臨床症状の悪化を抑制することにより、疾患の進行を平均約3年遅らせると推定されています(主にMCIから軽度AD、軽度ADから中等度ADへの進行遅延)。LEQEMBIが疾病の経過に与える影響を、米国社会における1人当たりの年間価値(現在価値)として、a)質調整生存年(QALY:Quality-Adjusted Life Year)の増加分(SOCとの比較)、b)支払意思額(WTP:Willingness to Pay)の閾値、c)総費用の差額(SOCとの比較)、d)投与期間の4要素の現在価値から、以下の式に従って算出しました。なお、医療経済評価で検討される費用やベネフィット、期間は、将来の価値を割引して現在価値として調整する必要があります。
a)QALYは健康アウトカムの価値を示す指標です。健康は生存年と生命の質の関数であるため、これらの価値を1つの指標数値にまとめる試みとしてQALYが開発されました。1QALYは、完全に健康な状態での1年間に相当します。LEQEMBIによる治療が、早期AD当事者様と介護者の健康アウトカムを改善することにより、当事者様は生涯で0.64 QALYs分を追加的に得られる(SOCと比し)と予測しています。b)1QALY獲得当たりのWTPは、その国の一人当たり国内総生産(GDP)の1~3倍が基準とされています。米国では費用対効果の閾値として5万ドルから15万ドルのWTPが用いられていますが11、ADのように社会的コストが大きく、介護者に甚大な影響を与える疾患の場合には、より高いWTP閾値である20万ドルの適用が考慮されます。c)総費用の差額については、早期AD当事者様一人当たりの生涯にわたるAD関連の直接的医療費・非医療費およびご家族を含む介護者の間接的費用の総額が、LEQEMBI治療によりSOCと比較して7,415ドル減少すると試算されました。直接費用には、当事者様の薬剤費、医療機関への通院費、入院費、施設入所費、コミュニティサービス費などが含まれます。間接費用としてはご家族を含む介護者の、介護活動に費やした時間に対する金銭的価値が考慮されます。d)治療期間については、中等度以上に進行した時点でLEQEMBIによる治療を中止する前提としています。早期ADにおける現在価値に割引後の平均治療期間は、約3.6年と推定されました。
4つの要素を現在価値に換算すると、a)0.64 QALYsの増加、b)1QALY獲得当たり WTP閾値20万ドル、c)総費用の差額7,415ドル、d)治療期間3.6年となり、社会的観点からのLEQEMBIの当事者様1人あたりの年間価値は37,600ドルと推定されます。
この年間価値37,600ドルを、米国社会における当事者様一人当たりの生涯価値に換算すると135,000ドル(0.64 × $200,000 + $7,415)となります。早期AD当事者様に対するLEQEMBIによる治療が10年にわたって徐々に拡大することを前提に、LEQEMBIは疾患進行を遅延させる「臨床的価値」、当事者様と介護者の生活の質と生産性の向上に資する「社会的価値」、そして医療サービスの需要を減少させる「経済的価値」として、米国社会に数百億ドル(several tens of billion dollars)の社会的インパクトをもたらす可能性があります。
LEQEMBIの米国での発売価格を年間26,500ドルに設定
当社は、LEQEMBIによる1人当たりの年間社会的価値を37,600ドルと推定していますが、より幅広い当事者様アクセスの促進、経済的負担の軽減、医療システムの持続可能性への貢献をめざし、LEQEMBIの年間卸業社購入価格(WAC:Wholesale Acquisition Cost)を年間社会的価値を下回る26,500ドルに設定することを決定しました(201試験およびClarity AD試験に基づき、米国の平均体重75kgの当事者様に10mg/kgを隔週点滴投与)。200mgバイアルのWACは254.81ドル、500mgバイアルのWACは637.02ドルとなります。なお、実際の年間価格は、当事者様によって変動します。また、LEQEMBIによりAβが除去された時点で、その臨床効果を維持しながら脳内Aβの再蓄積を防ぐために、LEQEMBIの維持投与レジメンとして現行の隔週投与から月1回投与にするなど、より少ない投与頻度の開発を引き続き行っています。これが実現すれば、維持投与期間中は投与量の減少によりLEQEMBIの年間コストは26,500ドルから約半額に低減するなど、年間価格を大幅に減ずる可能性があります。
当事者様のアフォーダビリティ(自己負担の軽減)
当社は、当事者様のアクセスやLEQEMBIの処方、それによるベネフィットを促進するためには、当事者様の支払い可能な水準(Patient Affordability)を考慮することが重要であると考えています。各当事者様が加入している保険でLEQEMBIがカバーされれば、本剤が適応される米国の早期AD当事者様のうち、91%の方はメディギャップ(追加保険)付きメディケアやメディケア アドバンテージ(メディケアが認証した私的保険プランで追加保険カバレッジが付く)、メディケイド、あるいは私的保険12でカバーされるため、LEQEMBIの自己負担額は1日当たり0ドルから数ドルの範囲となると想定しています。残りの約9%の方は追加保険のないメディケア受給者に該当し、この方々のメディケアPart Bの推定される自己負担分は、LEQEMBI薬剤費の20%となり、自己負担額は1日当たり約14.5ドル13となります。当事者様全体の加重平均自己負担金額は一日約2ドルと推定しています12。
当事者様のアクセスへの取り組み
当社は、経済的に困難な状況にある当事者様がLEQEMBIにアクセスできるように配慮します。第一に、Patient Assistance Programを設置し、保険未加入の方やメディケア受給者でも保険カバレッジが十分でない方などで、経済的支援の必要性などのプログラム基準を満たす方にはLEQEMBIを無償で提供します。第二に、上記の当事者様を含めて支援をする専任のLEQEMBI Patient Navigatorを設置し、LEQEMBIへのアクセスに関する情報、当事者様やご家族が加入している保険カバレッジの情報、新たな保険オプションに関する情報、対象者に対する経済的支援プログラムの情報の提供など、アクセス改善に向けたサポートを提供します。
医療システムの持続可能性
当社は、このLEQEMBIの価格設定アプローチは、早期AD当事者様における本剤の適正使用による医療システムの持続可能性の向上に寄与すると予測します。すなわち、当事者様の健康アウトカムおよびQOLの改善、疾患進行の遅延による医療サービス需要および包括的な疾病負担の軽減をもたらすと考えています。さらに、LEQEMBIの価格設定アプローチは、対象となる当事者数の規模、メディケアPart Bの過去の成長率および今後の支出予測を踏まえると、医療システムにとって持続可能性のあるアプローチであると考えています。
LEQEMBIによる社会的インパクトの半分以上を米国社会に還元
LEQEMBIの年間価格は26,500ドルであり、米国社会において試算された年間社会的価値である37,600ドルを11,100ドル下回る価格に設定しています。また、投与頻度の少ない維持療法の開発を進めており、これによりLEQEMBIの年間価格はさらに低減する可能性があります。今後10年間でLEQEMBIによる治療が徐々に拡大していけば、ディスカウントやリベートを含め、米国社会にもたらす可能性のある数百億ドルの社会的インパクトのうち約6割が米国社会に還元されると考えています14。この資源はAD発症リスクのある人々やADと共に生活される当事者様、ご家族、介護者の新たな健康や生活の質を向上するためのイノベーションを実現していくことに役立てることができます。
一方、この数百億ドルの社会的インパクトの約4割を、当社の製品売上として従業員・株主への価値といたしたいと考えます。我々はこれを新たなAD治療薬の研究開発ならびにADコミュニティにおける「共生と治療」をめざしたエコシステムの構築などの新たなイノベーションに投資してまいります14。
当社は、全てのステークホルダーズの価値最大化を追求したLEQEMBIの価格設定アプローチが、我々の企業理念に基づく社会善の実現である健康憂慮の解消と健康較差の是正につながると確信しています。
* Clinical Dementia Rating Sum of Box
以上
<参考資料>
米国における適応症および重要な安全性情報
適応症
LEQEMBIの適応症はアルツハイマー病(AD)の治療であり、LEQEMBIによる治療は、臨床試験と同様、ADによる軽度認知障害または軽度認知症の患者において開始すること。これらの病期よりも早期または後期段階での治療開始に関する安全性と有効性に関するデータはない。本適応症は、LEQEMBIの治療により観察されたAβプラークの減少に基づき、迅速承認の下で承認されており、臨床的有用性の確認するための検証試験データが本迅速承認の要件である。
重要な安全情報
警告・注意事項
アミロイド関連画像異常(ARIA)
-
- LEQEMBIはアミロイド関連画像異常(ARIA)として、脳磁気共鳴画像(MRI)で観察されるARIA浮腫/滲出液貯留(ARIA-E)、あるいはARIA脳表ヘモジデリン沈着(ARIA-H)として微小出血、脳表ヘモジデリン沈着症を引き起こす可能性がある。ARIAは通常無症候であるが、まれに痙攣、てんかん重積状態など、生命を脅かす重篤な事象が発生することがある。ARIAに関連する症状として、頭痛、錯乱、視覚障害、めまい、吐き気、歩行障害などが報告されている。また、局所的な神経障害が起こることもある。ARIAに関連する症状は、通常、時間の経過とともに消失する。
ARIAのモニタリングと投与管理のガイドライン
-
- LEQEMBIによる治療を開始する前に、直近1年以内のMRIを入手すること。5回目、7回目、14回目の投与前にMRIを撮影すること。
- ARIA-EおよびARIA-Hを発現した患者における投与の推奨は、臨床症状および画像判定による重症度によって異なる。ARIAの重症度に応じて、LEQEMBIの投与を継続するか、一時的に中断するか、あるいは中止するかは、臨床的に判断すること。
- ARIAの大半はLEQEMBIによる治療開始後14週間以内にみられることから、この期間は特に注意深く患者の状態を観察することが推奨される。ARIAを示唆する症状がみられた場合は臨床評価を行い、必要に応じてMRIを実施すること。MRIでARIAが観察された場合、投与を継続する前に慎重な臨床評価を行うこと。
- 症候性ARIA-E、もしくは無症候でも画像判定によって重度のARIA-Eとされた場合に投与を継続した経験はない。無症候でも画像判定によって軽度から中等度のARIA-Eとされた場合に投与を継続した症例に関する経験は限られている。ARIA-Eの再発症例への投与データは限られている。
ARIAの発現率
-
- 201試験において、LEQEMBI投与群の3%(5/161例)に症候性ARIAが発現した。ARIAに伴う臨床症状は、観察期間中に80%の患者で消失した。
- 無症候性ARIAを含めると、ARIAの発現率はLEQEMBI投与群の12%(20/161例)、プラセボ投与群の5%(13/245例)であった。ARIA-Eは、LEQEMBI投与群の10%(16/161例)、プラセボ投与群の1%(2/245例)で観察された。ARIA-Hは、LEQEMBI投与群の6%(10/161例)、プラセボ投与群の5%(12/245例)で観察された。プラセボと比較して、LEQEMBI投与によるARIA-Hのみの発現率の増加は認められなかった。
- 直径1cmを超える脳内出血は、LEQEMBI投与群の1名で報告されたが、プラセボ投与群では報告されなかった。他の試験では、LEQEMBIの投与を受けた患者において、致死的事象を含む脳内出血の発生が報告された。
アポリポ蛋白質Eε4(ApoE ε4)保有ステータスとARIAのリスク
-
- 201試験において、LEQEMBI投与群の6%(10/161例)がApoE ε4ホモ接合体保有者、24%(39/161例)がヘテロ接合体保有者、70%(112/161例)が非保有者であった。
- LEQEMBI投与群において、ApoEε4ホモ接合体保有者はヘテロ接合体保有者および非保有者よりも高いARIAの発現率を示した。LEQEMBIを投与された患者で症候性ARIAを発症した5人のうち4人はApoEε4ホモ接合体保有者であり、うち2人は重度の症状が認められた。LEQEMBI投与を受けた被験者で、ApoEε4ホモ接合体保有者ではApoEε4ヘテロ接合体保有者や非保有者と比較して症候性ARIAおよびARIAの発現率が高いことが、他の試験でも報告されている。
- ARIAの管理に関する推奨事項は、ApoE ε4保有者と非保有者で異ならない。
- LEQEMBIによる治療開始を決定する際に、ARIA発症リスクを知らせるためにApoE ε4ステータスの検査が考慮される。
画像による所見
-
- 画像による判定では、ARIA-Eの多くは治療初期(最初の7回投与以内)に発現したが、ARIAはいつでも発現し、複数回発現する可能性がある。LEQEMBI投与によるARIA-Eの画像判定による重症度は、軽度4%(7/161例)、中等度4%(7/161例)、重度1%(2/161例)であった。ARIA-Eは画像による検出後、12週までに62%、21週までに81%、全体で94%の患者で消失した。LEQEMBI投与によるARIA-H微小出血の画像判定の重症度は、軽度4%(7/161例)、重度1%(2/161人)であった。ARIA-Hの患者10人のうち1人は軽度の脳表ヘモジデリン沈着症を有していた。
抗血栓薬との併用と脳内出血の他の危険因子について
-
- 201試験では、ベースラインで抗凝固薬を使用していた被験者を除外した。アスピリンやクロピドグレルなどの抗血小板薬の使用は許可された。また、臨床試験中に併発事象の処置のため4週間以内の抗凝固薬を使用する場合は、LEQEMBIの投与を一時的に中断した。
- 抗血栓薬を使用した被験者はほとんどがアスピリンであり、他の抗血小板薬や抗凝固薬の使用経験は限られており、これらの薬剤の併用時におけるARIAや脳内出血のリスクに関しては結論づけられていない。LEQEMBI投与中に直径1cmを超える脳内出血が観察された症例が報告されており、LEQEMBI投与中の抗血栓薬または血栓溶解薬(組織プラスミノーゲンアクチベーターなど)の投与には注意が必要である。
- さらに、脳内出血の危険因子として、201試験においては以下の基準により被験者登録を除外している。直径1cmを超える脳出血の既往、4個を超える微小出血、脳表ヘモジデリン沈着症、血管性浮腫、脳挫傷、動脈瘤、血管奇形、感染病変、多発性ラクナ梗塞または大血管支配領域の脳卒中、重度の小血管疾患または白質疾患。これらの危険因子を持つ患者へのLEQEMBIの使用を検討する際には注意が必要である。
Infusion reaction
-
- LEQEMBIのInfusion reactionは、LEQEMBI投与群で20%(32/161例)、プラセボ投与群で3%(8/245例)に認められ、LEQEMBI投与群の多く(88%、28/32例)は最初の投与で発生した。Infusion reactionの重症度は軽度(56%)または中等度(44%)だった。LEQEMBI投与患者の2%(4/161例)において、Infusion reactionにより投与が中止された。Infusion reactionの症状には、発熱、インフルエンザ様症状(悪寒、全身の痛み、ふるえ、関節痛)、吐き気、嘔吐、低血圧、高血圧、酸素欠乏症がある。
- 初回投与後、一過性のリンパ球数の減少(0.9 x109/L未満)がプラセボ投与群の2%に対して、LEQEMBI投与群の38%に認められ、一過性の好中球数の増加(7.9 x109/Lを超える)はプラセボ投与群の1%に対して、LEQEMBI投与群の22%で認められた。
- Infusion reactionが発現した場合には、注入速度を下げ、あるいは注入を中止し、適切な処置を開始する。また次回以降の投与前に、抗ヒスタミン薬、アセトアミノフェン、非ステロイド性抗炎症薬、副腎皮質ステロイドによる予防的投与が検討される場合がある。
副作用
-
- 201試験において、プラセボ投与群の6%に対して、LEQEMBI投与群の15%が副作用により投与を中止した。LEQEMBIの投与中止に至った最も多い副作用は、Infusion reactionであり、LEQEMBI投与群の2%(4/161例)に対して、プラセボ投与群は1%(2/245例)だった。
- 201試験において、LEQEMBI投与群(N=161)の少なくとも5%に報告され、プラセボ投与群(N=245)より少なくとも2%高い発生率であった主な副作用は、Infusion reaction(LEQEMBI:20%、プラセボ:3%)、頭痛(LEQEMBI:14%、プラセボ:10%)、ARIA-E(LEQEMBI: 10%、プラセボ:1%)、咳(LEQEMBI:9%、プラセボ:5%)および下痢(LEQEMBI:8%、プラセボ:5%)だった。
米国における添付文書はこちらから入手できます。
1 Alzheimer’s Association, 2022 Alzheimer's Disease Facts and Figures
https://www.alz.org/media/Documents/alzheimers-facts-and-figures.pdf
2 Alzheimer’s Association, Changing the Trajectory of Alzheimer’s Disease:
https://www.alz.org/media/documents/changing-the-trajectory-r.pdf
3 Prados M, et al. Projecting the long‐term societal value of a disease‐modifying treatment for Alzheimer's disease in the United States. Alzheimers Dement. 2022; 18(1):142-151. doi: 10.1002/alz.12578. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9303743/
4 van Dyck. C, et al. Lecanemab in Early Alzheimer’s Disease. The New England Journal of Medicine. DOI: 10.1056/NEJMoa2212948. https://www.nejm.org/doi/full/10.1056/NEJMoa2212948
5 Swanson CJ, et al. A randomized, double-blind, phase 2b proof-of-concept clinical trial in early Alzheimer’s disease with lecanemab, an anti-Aβ protofibril antibody
https://alzres.biomedcentral.com/articles/10.1186/s13195-021-00813-8
6 Kansal AR, Tafazzoli A, Ishak KJ, Krotneva S. Alzheimer's disease Archimedes condition-event simulator: Development and validation. Alzheimers Dement (NY). 2018;4:76-88. Published 2018 Feb 16. doi:10.1016/j.trci.2018.01.001
7 Tafazzoli A and Kansal A. Disease simulation in drug development, External validation confirms benefit in decision making. The Evidence Forum. 2018. https://www.evidera.com/wp-content/uploads/2018/10/07-Disease-Simulation-in-Drug-Development_Fall2018.pdf
8 Tafazzoli A, Weng J, Sutton K, et al. Validating simulated cognition trajectories based on ADNI against 436 trajectories from the National Alzheimer's Coordinating Center (NACC) dataset. 11th edition of Clinical Trials on 437 Alzheimer's Disease (CTAD); Barcelona, Spain: 2018.
9 Tahami Monfared AA, et al. Long-term health outcomes of lecanemab in patients with early Alzheimer's disease using simulation modeling. Neurol Ther. 2022;11:863–880.
https://link.springer.com/article/10.1007/s40120-022-00350-y
10 Tahami Monfared AA, et al. The Potential Economic Value of Lecanemab in Patients with Early Alzheimer’s Disease Using Simulation Modeling, Neurol Ther. 2022;11: 1285–1307.
https://link.springer.com/article/10.1007/s40120-022-00373-5
11 ICER Value Framework 2020-2023. 2022.
https://icer.org/wp-content/uploads/2020/11/ICER_2020_2023_VAF_02032022.pdf
12 IQVIA. Longitudinal Access and Adjudication DATA (LAAD) 2019-2021
13 20% of the WAC price ($26,500) divided by 365 (days)
14 Internal Eisai calculations, December 2022
将来見通しに関する注意事項
本発表において提供される資料ならびに情報は、いわゆる「見通し情報」(forward-looking statements)を含みます。これらの文言は、現在における見込み、予測、リスクを伴う想定、実質的にこれらの文言とは異なる現実的な結論、結果を招き得る 不確実性に基くものです。
それらリスクや不確実性には、一般的な業界ならびに市場の状況、金利、通貨為替変動といった一般的な国内および国際的な経済状況が含まれます。リスクや不確実性は、特に製品に関連した見通し情報に存在します。製品のリスク、不確実性には、技術的進歩、特許の競合他社による獲得、臨床試験の完了、製品の安全性ならびに効果に関するクレームや懸念、規制機関による審査期間や承認取得、国内外の保健関連改革、マネジドケア、健康管理コスト抑制への傾向、国内外の事業に影響を与える政府の法規制など、新製品開発に付随する課題などが含まれますが、これらに限定されるものではありません。
新しい情報、将来の出来事もしくはその他の事項より、見通し情報に更新もしくは改正が望ましい場合であっても、それを行う意図を有するものではなく、義務を負うものではありません。