- 印刷用
- 2021年11月9日
エーザイ株式会社(本社:東京都、代表執行役CEO:内藤晴夫)は、このたび、セントルイス・ワシントン大学医学部(米国ミズーリ州セントルイス)が主導する優性遺伝アルツハイマーネットワーク試験ユニット(Dominantly Inherited Alzheimer Network Trials Unit、以下 DIAN-TU)が実施する優性遺伝アルツハイマー病(DIAD)に対する臨床試験(Tau NexGen試験)について、米国食品医薬品局(FDA)と欧州医薬品庁(EMA)の合意のもと、抗アミロイドβ(Aβ)治療薬による基礎療法を含めるように試験デザインが変更されたことをお知らせします。本試験は、当初、タウ標的療法の効果を評価することとしていましたが、 Aβ標的療法によりアルツハイマー病(AD)のバイオマーカーが低下することを示す臨床試験のエビデンスが増えていることを受け、当社の抗Aβプロトフィブリル抗体レカネマブ(一般名、開発品コード:BAN2401)を抗Aβ療法による基礎療法とすることが決定されました。
ADを発症することが知られている遺伝子変異を有する方々は、多くは発症した親とほぼ同じ年齢である50代、40代、あるいは30代であっても症状を発現する傾向があります(優性遺伝アルツハイマー病:DIAD)。2021年3月に、DIAN-TU は当社が英国のユニバーシティ・カレッジ・ロンドン(University College London)と共同で創製した抗MTBR(Microtubule binding region: 微小管結合領域)タウ抗体E2814(開発品コード)を本試験の最初の抗タウ治療薬候補として選定しました。
本試験の目的は、ADの原因となる遺伝子変異を有する症候性と無症候性の人々に対して、治験薬の安全性、忍容性、バイオマーカーおよび認知機能への効果を評価することです。本試験は、治験薬による治療が認知障害の進行を抑制するか、また疾患関連バイオマーカーを改善するかについて評価します。
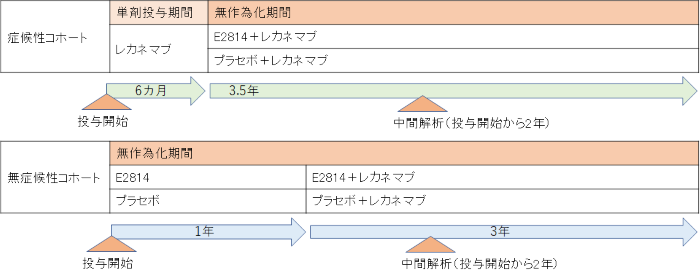
今回の試験デザインの変更によって、症候性の被験者に対しては、レカネマブを6カ月間投与した後に、E2814またはプラセボ投与が追加されるようにランダムに割り当てられます。ADでは脳内でタウ蓄積に先立ってAβ蓄積が起こるため、この研究デザインにより、Aβの除去が抗タウ治療薬の最も効果的な薬効発揮につながるかどうかを評価することができます。一方、無症候性の被験者に対しては、抗タウ治療薬もしくはプラセボがランダムに割り当てられ、1年間の投与後に、両群にレカネマブ投与が追加されます。このように薬剤の投与時期をずらすことにより、2種類の薬剤の併用効果を評価する前に、抗タウ治療薬の単剤の効果を評価することができます。主要評価項目は、症候性の被験者に対するPETスキャンで観察される脳内タウ蓄積の抑制(E2814の上乗せ効果)であり、主要な副次評価項目は、無症候性の被験者の脳脊髄液(CSF)中の特定のタウであるp217tauに対する効果(E2814単剤ならびにレカネマブ併用の効果)です。試験開始から2年後の解析により、主要および副次評価項目が達成された場合、試験はさらに2年間継続され、薬剤が認知機能の低下に与える影響とタウの変化を評価します。
DIAN-TUのディレクター、治験責任医師でセントルイス・ワシントン大学医学部のCharles F. and Joanne Knight Distinguished Professor of NeurologyであるRandall J. Bateman, M.D.は、「Aβプラークの除去によりAβとタウに生物学的な有用性をもたらすというエビデンスが増えていることから、ADの病態であるAβとタウの神経原繊維変化の両方を同時に標的にすることで、試験成功の可能性が最も高くなると考えています」と述べています。
エーザイ ニューロロジービジネスグループのチーフクリニカルオフィサーであるLynn Kramer, M.D.は、「当社の抗MTBRタウ抗体E2814は、タウタンパク質を標的とするように設計されたDIAN-TUのTau NexGen試験において最初の抗タウ治療薬として選択されました。脳内Aβプラークを取り除くことで認知機能低下を遅らせることを示唆するエビデンスが増えており、この深刻な疾患の治療への可能性が出てきています。このたび、当社が開発中の抗Aβプロトフィブリル抗体レカネマブが、本試験において抗Aβ治療薬の基礎療法として選択されたことをうれしく思います。臨床第Ⅱb相試験では、レカネマブ10 mg/kg biweekly投与において、漸増投与を必要とせず、早い段階から脳内Aβプラークを確実に除去し、早期ADの認知機能低下を抑制することが示唆されました。また、レカネマブの10 mg/kg biweekly投与による、アミロイド関連画像異常(ARIA-E:浮腫/浸出)の発現率は9.9%であり、そのうち症状を伴うものは2%未満でした」と述べています。
当社は、神経領域を重点領域の一つと位置づけ、最先端の研究から革新的な創薬を行っており、引き続きADを含む認知症をはじめとするアンメット・メディカル・ニーズの高い疾患において、当事者様とそのご家族の多様なニーズの充足とベネフィット向上により一層貢献してまいります。
以上
<参考資料>
- 1. The Dominantly Inherited Alzheimer Network(DIAN)について
DIANは優性遺伝アルツハイマー病(DIAD)に焦点を置いた国際的な研究活動団体です。DIADは、稀な遺伝性遺伝子変異によって生じるADで、AD当事者様の総数の1%未満の方がこの病気を患っています。典型的には30代から50代にかけて、記憶消失や認知症を引き起こします。DIAN-TUの目標は、この病気、また可能性として、全ての型のADを治療または予防する解決策を見つけることです。DIAN-TUはDIANの臨床研究部門で、DIADを持つまたは危険因子のある方を対象とした介入治験のデザインと管理に特化している官民国際パートナーシップです。
- 2. TauNexGen試験について
TauNexGen試験の目的は、ADの原因となる遺伝子変異を有する症候性と無症候性の人々に対して、治験薬の安全性、忍容性、バイオマーカーおよび認知機能への効果を評価することです。今回の試験デザインの変更によって、症候性の被験者に対しては、レカネマブを6カ月間投与した後に、E2814またはプラセボ投与が追加されるようにランダムに割り当てられます。無症候性の被験者に対しては、抗タウ治療薬もしくはプラセボがランダムに割り当てられ、1年間の投与後に、両群にレカネマブ投与が追加されます。試験開始から2年後の解析により、主要および副次評価項目が達成された場合、試験はさらに2年間継続されます。
- 3. レカネマブ(開発品コード: BAN2401)について
レカネマブは、BioArctic AB(本社:スウェーデン、以下 バイオアークティック)とエーザイの共同研究から得られた、可溶性のアミロイドβ(Aβ)凝集体(プロトフィブリル)に対するヒト化モノクローナル抗体です。レカネマブは、ADを惹起させる因子の一つと考えられている、神経毒性を有するAβプロトフィブリルに選択的に結合して無毒化し、脳内からこれを除去することでADの病態進行を抑制する疾患修飾作用が示唆されています。早期ADを対象とした大規模臨床第Ⅱ相試験(201試験)においては、事前に規定した18カ月投与における解析の結果は、脳内Aβ蓄積量の減少(p<0.0001)とADCOMS*による臨床症状の悪化抑制(p<0.05)を示しました。なお、12カ月投与時における主要評価項目**は達成しませんでした。201試験(コア期間)の後、投与を休止していたギャップ期間(平均24カ月)を経て、レカネマブ10mg/kg bi-weekly投与の安全性と有効性を評価するOpen-Label Extension試験が進行中です。
エーザイは、本抗体について、2007年12月にバイオアークティックとのライセンス契約により、全世界におけるアルツハイマー病を対象とした研究・開発・製造・販売に関する権利を取得しています。2014年3月に、エーザイとバイオジェンはレカネマブに関する共同開発・共同販促に関する契約を締結し、2017年10月に内容の一部変更契約を締結しています。現在、臨床第Ⅱ相試験(201試験)のOpen-Label Extension試験および早期ADを対象とした検証用の一本の臨床第Ⅲ相試験(Clarity AD)を実施中です。また、2020年7月に、臨床症状は正常で、ADのより早期ステージにあたる脳内Aβ蓄積が境界域レベルおよび陽性レベルのプレクリニカルADを対象とした臨床第Ⅲ相試験(AHEAD 3-45試験)を米国のADおよび関連する認知症の学術的臨床試験のための基盤を提供するAlzheimer's Clinical Trials Consortium(ACTC)と共同で開始しました。AHEAD 3-45試験は、National Institutes of Health、National Institute on Agingによる資金提供を受けています。
2021年6月、レカネマブは米国食品医薬品局(FDA)から重篤なあるいは命にかかわる疾患に関する薬剤の開発および審査の迅速化を目的とした制度であるブレイクスルーセラピーの指定を受けています。2021年9月に迅速承認制度を活用して、FDAに早期ADを適応疾患として生物製剤ライセンス申請の段階的申請を開始しました。
* ADCOMS (Alzheimer’s Disease Composite Score):アルツハイマー病コンポジットスコアは、早期ADの変化を感度よく検出することを目的とし、ADAS-cog (Alzheimer’s Disease Assessment Scale-cognitive subscale)、MMSE (Mini-Mental State Examination)、CDR (Clinical Dementia Rating)の3つの臨床評価尺度を組み合わせたエーザイが開発した評価指標
** 投与12カ月時点においてADCOMSによる臨床症状の抑制がプラセボ投与群に対し25%低下する確率が80%以上とする
- 4. E2814について
E2814は抗MTBR(Microtubule binding region)タウ抗体です。E2814は、エーザイとユニバーシティ・カレッジ・ロンドンとの共同研究を通じて見出されました。E2814は、孤発性ADを含むタウオパチーに対する疾患修飾薬として開発され、臨床第Ⅰ相試験が実施中です。E2814は、タウ伝播種の脳内拡散を抑制する抗体として設計されています。
