- 印刷用
- 2016年12月12日
エーザイ株式会社(本社:東京都、代表執行役CEO:内藤晴夫)は、12月8日から10日に米国サンディエゴで開催された第9回アルツハイマー病臨床試験会議(Clinical Trials on Alzheimer's Disease: CTAD 2016)において、自社創製の経口BACE(βサイト切断酵素)阻害剤elenbecestat※(開発コード E2609)の二つの臨床試験(202試験および006試験)に関する最新データを発表しましたのでお知らせします。
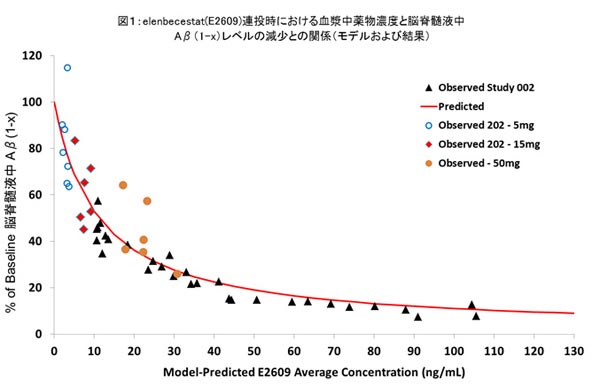
202試験は、PET(陽電子放射断層撮影)を用いたスクリーニングによってアミロイドベータ(Aβ)の蓄積が確認されたアルツハイマー病(AD)による軽度認知障害および軽度~中等度アルツハイマー型認知症患者様を対象としたelenbecestatの安全性とAβ濃度の変化を評価する、多施設共同、無作為化、二重盲検、プラセボ対照並行群間比較臨床第Ⅱ相試験です。elenbecestat投与においては、5、15、50mg/日の3つの投与群が設定され、Aβ濃度の変化はelenbecestat投与前後における血漿中および脳脊髄液中のAβ(1-x)*レベルを測定することにより評価しました。CTAD 2016においては、薬物動態・薬力学データの予備的な解析結果について発表しました(ポスター発表番号:P3-28)。
202試験においては、健康成人を対象とした臨床第Ⅰ相試験から得られた結果と同じく、投与量に相関した血漿中薬物濃度を確認しました。また、202試験における血漿中薬物濃度と脳脊髄液中Aβ(1-x)レベルの減少との間には相関性がみられ、臨床第Ⅰ相試験データも含めた薬物濃度‐反応性相関モデルと合致しました(図1参照)。
- *Aβ(1-x)は全ての長さのAβペプチドの量を示しています。
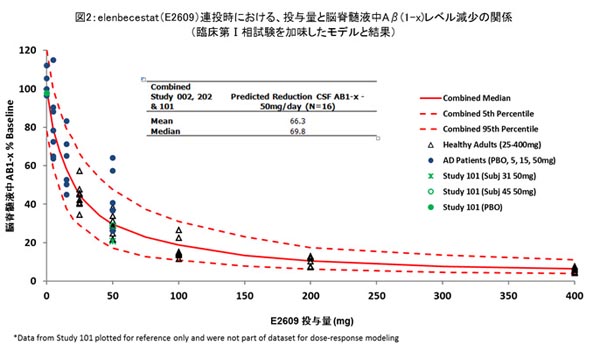
さらに投与量と脳脊髄液中Aβ(1-x)レベルの減少の関係は、臨床第Ⅰ相試験のデータも加味して構築したモデルで説明が可能であり、202試験における脳脊髄液中Aβ(1-x)レベルの減少は、本モデルと合致しました(図2参照)。50mg/日投与においては、中央値として70%の脳脊髄液中Aβ(1-x)レベルの減少が得られると推定されました。これらの結果から、現在実施している臨床第Ⅲ相試験(MISSION AD)では、50mg/日の1用量によって本剤の有効性と安全性を検証します。
006試験は、elenbecestatのグローバル臨床試験への日本人患者様のエントリーを可能とするために実施された、薬物動態、薬力学及び安全性に関する人種差の有無を確認するブリッジング試験(臨床第Ⅰ相試験)です。(ポスター発表番号:P3-27)。本試験は、日本人および白人の健康成人にelenbecestatを単回投与する無作為化、二重盲検、プラセボ対照試験として、日本人には5mg、50mg、200mg/日の3用量、白人には50mg/日の1用量を投与しました。
その結果、日本人において、血漿中のAβ(1-x)レベルの用量依存的な減少が認められました。また、薬物動態及び血漿中のAβ(1-x)レベルを指標とする薬力学作用は日本人と白人において類似していました。安全性についても人種間による大きな違いは見られませんでした。
Elenbecestatは、経口のアルツハイマー病治療剤として臨床第Ⅲ相試験(MISSION AD)を実施中の、自社創製のBACE阻害剤です。elenbecestatはAβ産生の律速酵素であるBACEを阻害することで、毒性種と考えられる脳内Aβのオリゴマーやプロトフィブリルへの凝集、その後のアミロイドプラーク(凝集斑)の形成に繋がると考えられているAβを減少させます。アミロイドプラーク形成の減少は、アルツハイマー病の病態進行を抑制させると期待されています。当社は、elenbecestatをバイオジェン・インク(本社:米国マサチューセッツ州、CEO:George A. Scangos)と共同開発しています。また、elenbecestatの開発について、米国食品医薬品局(FDA)よりファストトラック指定を受けています。
当社は、認知症領域を重点疾患領域と位置づけ、elenbecestatをはじめとする新たな薬剤の開発に注力しています。有望な治療剤を一日でも早く世界の患者様にお届けできるよう邁進してまいります。
- ※現時点で最終確定したものではありません。
以上
<参考資料>
1. Elenbecestat(一般名、開発コード:E2609)の臨床第Ⅲ相試験プログラム(MISSION AD)について
Elenbecestatの臨床第Ⅲ相試験プログラム(MISSION AD)は、MISSION AD1(301試験)およびMISSION AD2(302試験)の2つのグローバルな臨床第Ⅲ相試験から構成されます。
MISSION ADプログラムの最初の試験となるMISSION AD1は、バイオマーカーで早期ADと判定した患者様を対象にelenbecestatの有効性と安全性を検証する、多施設共同、プラセボ対照、二重盲検、並行群間比較試験です。投与期間を24カ月、実薬群は50mg/日の1用量とし、1,330人の患者様を実薬群とプラセボ群に1:1の割合で無作為に割り付けます。また、臨床的認知症重症度判定尺度(Clinical Dementia Rating Sum of Boxes:CDR-SB)を主要評価項目として用います。
2. エーザイとバイオジェンによる共同開発契約について
本契約は、両社がBACE阻害剤elenbecestatと抗Aβプロトフィブリル抗体BAN2401について、エーザイ主導のもとでグローバルでの承認取得に向けた開発を進め、承認取得後は日米欧などの主要な地域において共同販促を行うものです。両社はelenbecestatとBAN2401に係る研究開発費等の費用を折半し、共同販促に基づく売上高はエーザイに計上され、利益は両社で等しく分配します。また、エーザイは、バイオジェンより契約一時金を取得したほか、今後共同開発の進捗、承認取得および売上高達成に応じたマイルストンペイメントを受け取ります。また、エーザイは、バイオジェンがAD治療剤として開発している抗Aβ抗体「aducanumab」および抗tau抗体に対して、共同開発および共同販促に係わるオプション権を保有しています。
