- 印刷用
- 2013年7月29日
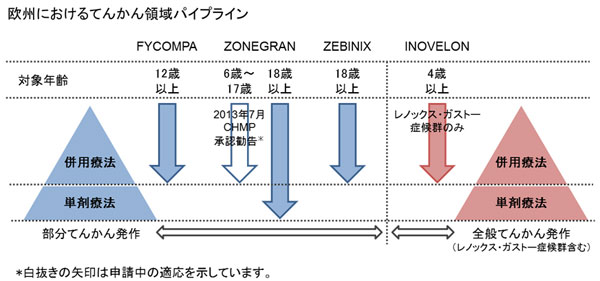
エーザイ株式会社(本社:東京都、社長:内藤晴夫)は、英国子会社であるエーザイ・リミテッドが提出していた抗てんかん剤「Zonegran®」(一般名:ゾニサミド)に関する小児適応の追加申請について、欧州医薬品庁(European Medicines Agency:EMA)の医薬品委員会(Committee for Medicinal Products for Human Use:CHMP)より承認勧告(positive opinion)を受領しましたので、お知らせします。本申請は部分発作(二次性全般化発作を含む)に対する併用療法としての適応の対象年齢を、従来の18歳以上の成人てんかん患者様から6歳以上の小児患者様まで拡大することをめざすものです。
本剤は、大日本製薬株式会社(現、大日本住友製薬株式会社)が創製した抗てんかん剤であり、欧州では当社が開発を行い、2005年3月に成人部分てんかん(二次性全般化発作を含む)の併用療法として承認を取得しました。また、2012年6月27日には、新規に診断された同適応症に対する、単剤療法としての適応を取得し、現在、当社の欧州子会社が販売を行っています。
このたびの申請に用いた臨床第Ⅲ相試験(312試験)は、多施設共同、無作為化、二重盲検、プラセボ対照試験として実施され、1~2種類の抗てんかん薬での治療歴を持つ部分発作を有する6~17歳の小児てんかん患者様207人を対象に、ゾニサミドの併用療法について評価されました。本試験の結果、ゾニサミドはプラセボと比較して有意に高い50%レスポンダーレート(発作頻度が50%以上減少した症例の割合)を示しました。有害事象の発生率は、ゾニサミド投与群とプラセボ投与群とでほぼ同じであり、本試験においてプラセボ投与群に比してゾニサミド投与群でより多く報告された有害事象は、食欲減退、体重減少、眠気、嘔吐および下痢でした。
当社は、てんかん領域を重点疾患領域と位置づけ、欧州では部分てんかん治療剤として、自社創製の新規作用機序を有するAMPA受容体拮抗剤「Fycompa®(一般名:ペランパネル)」、「Zonegran®」、「Zebinix®」を、また小児の早期から発症する重篤なてんかんであるレノックス・ガストー症候群の治療剤として「Inovelon®」を販売しています。当社は、てんかん領域における、豊富な製品ラインナップに基づいた複数の治療オプションを提供することで、てんかん患者様とそのご家族の多様なニーズの充足とベネフィット向上に、引き続き貢献してまいります。
以上
[参考資料として、Zonegran®:312試験、エーザイのてんかん領域での取り組みについて添付しています]
<参考資料>
1. Zonegran®(ゾニサミド):312試験について
312試験は、多施設共同、無作為化、二重盲検、プラセボ対照試験として、1~2種類の抗てんかん薬での治療歴を持つ部分発作を有する6~17歳の小児てんかん患者様207人を対象に、ゾニサミドの併用療法について評価することを目的に、欧州およびインドで実施されました。患者様はプラセボまたはゾニサミド投与群のいずれかに割り付けられ、20週間投与(8週間で目標量まで用量漸増の後、12週間の用量維持療法)を受けました。試験を完了した患者様(ゾニサミド投与群:86.9%、プラセボ投与群:90.0%)の内、主要評価項目である12週間の用量維持療法期間中の50%レスポンダーレート(発作頻度が50%以上減少した症例の割合)は、プラセボ投与群で31.0%、ゾニサミド投与群で50.5%と、プラセボに比較してゾニサミド投与群で高い有効性を示しました。安全性と忍容性に関して全有害事象の発生率は、ゾニサミド投与群(55.1%)とプラセボ投与群(50.0%)とでほぼ同じであり、そのうち重篤な有害事象はゾニサミド投与群で3.7%、プラセボ投与群で2.0%、また有害事象による投薬の中断はゾニサミド投与群で0.9%、プラセボ投与群で3.0%観察されました。本試験においてプラセボ投与群に比してゾニサミド投与群でより多く報告された有害事象は食欲減退(ゾニサミド:6.5%、プラセボ:4.0%)、体重減少(ゾニサミド:4.7%、プラセボ:3.0%)、眠気(ゾニサミド:4.7%、プラセボ:2.0%)、嘔吐(ゾニサミド:3.7%、プラセボ:2.0%)および下痢(ゾニサミド:3.7%、プラセボ:1.0%)でした。
2. エーザイのてんかん領域での取り組みについて
エーザイは、てんかん領域を重点疾患領域と位置づけています。自社創製のAMPA受容体拮抗剤「Fycompa®(ペランパネル)」は、新規作用機序を有する部分てんかんの治療剤として、2013年7月現在、欧米を含む30カ国以上で承認を取得しており、欧州では2012年9月より販売を開始しています。また、欧州におけるてんかん領域の製品群として、成人部分てんかんの併用療法を適応とする「Zonegran®」(ライセンス元:大日本住友製薬株式会社、Na/Caチャネル阻害等に基づく抗てんかん剤)、「Zebinix®」(ライセンス元:BIAL-Portela&Ca社、電位依存性Naチャネル阻害に基づく抗てんかん剤)を、また小児の早期から発症する重篤なてんかんであるレノックス・ガストー症候群の併用療法として「Inovelon®」(ライセンス元:Novartis社、Naチャネル阻害作用に基づく新規トリアゾール骨格の抗てんかん剤)を販売しています。「Zonegran®」は2012年6月に、欧州における成人部分てんかんの単剤療法の適応が承認されており、このたび小児部分てんかん併用療法における追加適応の申請について欧州医薬品庁(European Medicines Agency:EMA)の医薬品委員会(Committee for Medicinal Products for Human Use:CHMP)より承認勧告(positive opinion)を受領しました。