- 印刷用
- 2011年5月17日
エーザイ株式会社(本社:東京都、社長:内藤晴夫)は、このたび、当社が創製・開発した新規抗がん剤「HALAVEN®」(エリブリンメシル酸塩)が、「アントラサイクリン系、タキサン系およびカペシタビンなどの抗がん剤を含むがん化学療法による前治療歴のある局所進行性・転移性乳がん」患者様に対する単剤療法として、スイス連邦医薬品庁(Swissmedic)より承認を取得した、と発表しました。
当社は、アンメット・メディカル・ニーズの高い後期転移性乳がんに対して 「HALAVEN®」を少しでも早く患者様にお届けすべく、スイス、シンガポール審査当局に対して211試験(第Ⅱ相臨床試験)等をもっていち早く申請しました。Swissmedicでは本剤のグローバル第Ⅲ相臨床試験であるEMBRACE試験(Eisai Metastatic Breast Cancer Study Assessing Treatment of Physician's Choice vs Eribulin E7389)とともに審査中でした。なお、シンガポールでは2011年2月に承認を取得しています。
今回のSwissmedicによる「HALAVEN®」の承認によってスイスの後期転移性乳がんの患者様がこの革新的な治療薬にアクセスすることが可能となります。乳がんは、世界中で2番目に多く診断されるがんであり、毎年約130万人が罹患しています。スイスでは、乳がん患者様数が5,000人を越え、毎年、約1,400人が乳がんで亡くなられています1), 2)。
本剤は、米国(2010年11月)、シンガポール(2011年2月)、欧州(2011年3月)で承認を取得しており、2011年4月には日本でも承認されました。今回の承認は世界で5番目となるほか、本剤は現在、カナダで承認審査中です。
当社は、ヒューマン・ヘルスケア(hhc)理念の一環として、患者様とそのご家族のために全力を尽くし、世界各地の患者様に一日でも早く「HALAVEN®」をお届けすることをめざしてまいります。
以上
[参考資料として211試験、EMBRACE試験、スイスの乳がんについて添付しています]
<参考資料>
1. 211試験
211試験は、HALAVEN®の有効性、安全性を評価するために行ったフェーズⅡ、非盲検、単群試験です。試験の対象は、前治療としてアントラサイクリン系、タキサン系、カペシタビンなどの抗がん剤投与を受けていた局所進行性または転移性乳がん患者様で、直近の治療を受けて6ヵ月以内に病状悪化が記録された難治症例です。患者様299例のうち、291例にHALAVEN®が投与されました。主要な対象患者基準を満たした患者様数は269例で、治験医師評価による奏功率は14.1%、1例が完全寛解でした。患者様のほぼ半数(46.5%)が、HALAVEN®を投与した後、病勢安定を示し、臨床的有用性は17.1%でした。奏功期間は42~258日で、中央値は4.2ヵ月でした。無増悪生存期間は1~398日で、中央値は2.6ヵ月でした。全生存期間は19~604日で、中央値は10.3ヵ月でした。6ヵ月無増悪生存期間と全生存期間率は、それぞれ16.0%と72.3%でした。
安全性解析では、最も高い頻度で報告されたグレード3またはグレード4の有害事象は、好中球減少が54%、発熱性好中球減少が5.5%、白血球減少が14%、および脱力感/疲労感(10%、グレード4は認められず)でした。グレード3の末梢神経障害が患者の5.5%に報告されましたが、グレード4の末梢神経障害は報告されませんでした。
2. グローバル第Ⅲ相臨床試験(EMBRACE試験)
EMBRACE試験は、多施設、無作為、非盲検、並行2群間比較試験で、HALAVEN®投与群と治験医師選択療法施行群との間で全生存期間を比較するようにデザインされました。本試験では、2種類から5種類のがん化学療法剤(アントラサイクリン系およびタキサン系抗がん剤を含む)による前治療歴のある、局所再発性あるいは転移性乳がんの患者様762名が対象となり、HALAVEN®投与群と治験医師選択療法施行群に2:1の比率で割り付けられました。治験医師選択療法施行群は、がん治療が認可された単剤化学療法、ホルモン療法、生物学的薬剤治療、または苦痛緩和治療、放射線治療と定義され、大多数(97%)の患者様は単剤化学療法を受けました。
HALAVEN®投与群で高頻度(頻度25%以上)に認められた有害事象は、無気力(疲労感)、好中球減少、貧血、脱毛症、末梢神経障害(無感覚、手足等のしびれ)、吐き気、便秘でした。この中で、特に重篤な有害事象として報告されたのは好中球減少(発熱を伴う症例が4%、発熱を伴わない症例が2%)であります。またHALAVEN®投与中止に至った主な有害事象は末梢神経障害(5%)でした。
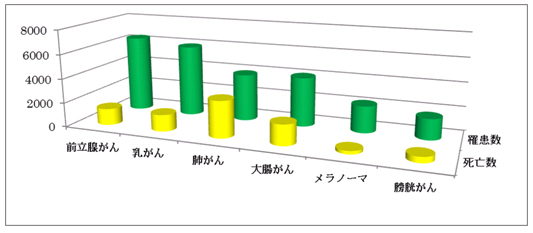
3. スイスのがんについて3)
2008年スイスでは、5,918人が乳がんと診断され、1,367人が亡くなっています。
- 1)
Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008, Int. J. Cancer: 127, 2893–2917 (2010)
( http://onlinelibrary.wiley.com/doi/10.1002/ijc.25516/full) - 2)
- 3)
Estimates of the cancer incidence and mortality in Europe in 2006, Annal of Oncology 18: 581 (2007)
