- 研究開発
- 製品情報
- 印刷用
- 2025年1月7日
金沢大学
エーザイ株式会社
金沢大学医薬保健研究域医学系の小野賢二郎教授と、エーザイ株式会社の共同研究グループは、新しく開発したレカネマブ関連アミロイドβプロトフィブリル(Lec-PF)測定系を用いて、ヒト脳脊髄液中のLec-PF濃度を測定しました。その結果、非アルツハイマー病の対照者に比してアルツハイマー病による軽度認知障害および認知症の幅広い病期で、脳脊髄液中のLec-PF濃度が上昇していること、および脳脊髄液中のLec-PF濃度は神経変性を反映するバイオマーカーと有意に相関することを示しました。
レカネマブ(※1)は、プラークの除去作用に加えてアミロイドβプロトフィブリル(amyloid-β protofibril:PF(※2))に選択的に結合するユニークなデュアルアクションを有する抗体で、アルツハイマー病(※3)による軽度認知障害および軽度認知症の方(総称して早期AD)が対象となる治療薬です。本研究結果より、アルツハイマー病患者の脳脊髄液中にはレカネマブが捕捉するPF(Lec-PF)が存在すること、Lec-PFは神経変性に関連する高毒性の病態タンパクであることが示唆され、レカネマブがアルツハイマー病の病態進行抑制効果を示すメカニズムの一端が明らかになりました。
これらの知見より、今後、脳脊髄液中のLec-PF濃度をレカネマブ治療前後で測定し、レカネマブ治療の有効性判定に将来活用できる可能性があります。また、脳脊髄液中のLec-PF濃度は総タウ(total-tau)(※4)、ニューログラニン(※5)などの神経変性マーカーと強く相関することから、アルツハイマー病患者の予後予測にも活用できることが期待されます。
本研究は2025年1月6日18時30分(米国東海岸標準時間)に国際学術誌『Annals of Neurology』のオンライン版に掲載されました。
【研究の背景・目的】
アルツハイマー病(AD)の原因として、アミロイドβ(Aβ)(※6)が神経細胞外に異常凝集し、次いでタウ神経原繊維変化が生じて神経細胞の障害をきたし、疾病を発症するというアミロイドカスケード仮説が有力であると考えられています。異常凝集したAβの中でもPFは最終段階のアミロイドフィブリルやプラークよりも神経毒性が高く、PFが神経変性を引き起こしている可能性が考えられています(Amin L and Harris DA. 2021、参考文献)。レカネマブは、2023年より早期ADに対する治療薬として、医療現場で使用されています。しかし、ヒト生体試料中のPF濃度を測定した例はこれまでになく、レカネマブの治療標的であるPFのAD病態進行における役割は、明確に解明されていません。
本研究では、プレクリニカルAD(※7)、ADによる軽度認知障害および認知症の方と、SNAP(非AD認知障害の被験者)(※8)および正常認知機能の方を対象として、新しく開発した高感度のLec-PF測定系を用いてヒト脳脊髄液中のLec-PF濃度を測定し、Aβ40、Aβ42、リン酸化タウ(p-tau)181(※9)、p-tau 217、総タウ(total-tau)、およびニューログラニン濃度との関連を解析しました。
【研究成果の概要】
脳脊髄液中のLec-PF濃度は、正常認知機能の方(図1のYNC、AMC群)に比してADによる軽度認知障害および認知症の方(図1のMCI+、AD+群)で有意に高値でした。
また、脳脊髄液中のLec-PF濃度と他の脳脊髄液マーカー(Aβ42、Aβ42/40比、p-tau 181、p-tau 217、total-tau、ニューログラニン)との相関解析を行いました。図2はLec-PFと各種脳脊髄液マーカーのSpearmanの相関係数(95%信頼区間)を示しています。被験者全体において(図2の黒線)、脳脊髄液中のLec-PF濃度は、Aβ42、Aβ42/40比、p-tau 181、p-tau 217、total-tau、ニューログラニンの全てとSpearman係数0.2以上の相関を認めました。特筆すべきことは、Aβ陽性群のみに着目した場合(図2の赤線)、 Lec-PFは AD病理であるAβカスケードの Aβの下流にあたる神経変性マーカーであるtotal-tau、およびニューログラニンとSpearman係数0.4以上の強い相関を示し、Lec-PFは神経変性に関連する高毒性の病態タンパクであることが示唆されました。
【今後の展開】
脳脊髄液中のLec-PF濃度をレカネマブ治療前後で測定すれば、レカネマブ治療の有効性判定に活用できる可能性があります。また、脳脊髄液中のLec-PF濃度は神経変性マーカーと強く相関することから、AD患者の予後予測にも活用できる可能性があります。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)認知症研究開発事業(課題番号22dk0207053)、科学研究費助成事業学術領域変革研究(課題番号23H03850)および科学研究費助成事業基盤研究(課題番号JP19k07965、JP22k07514)の支援を受けて実施されました。
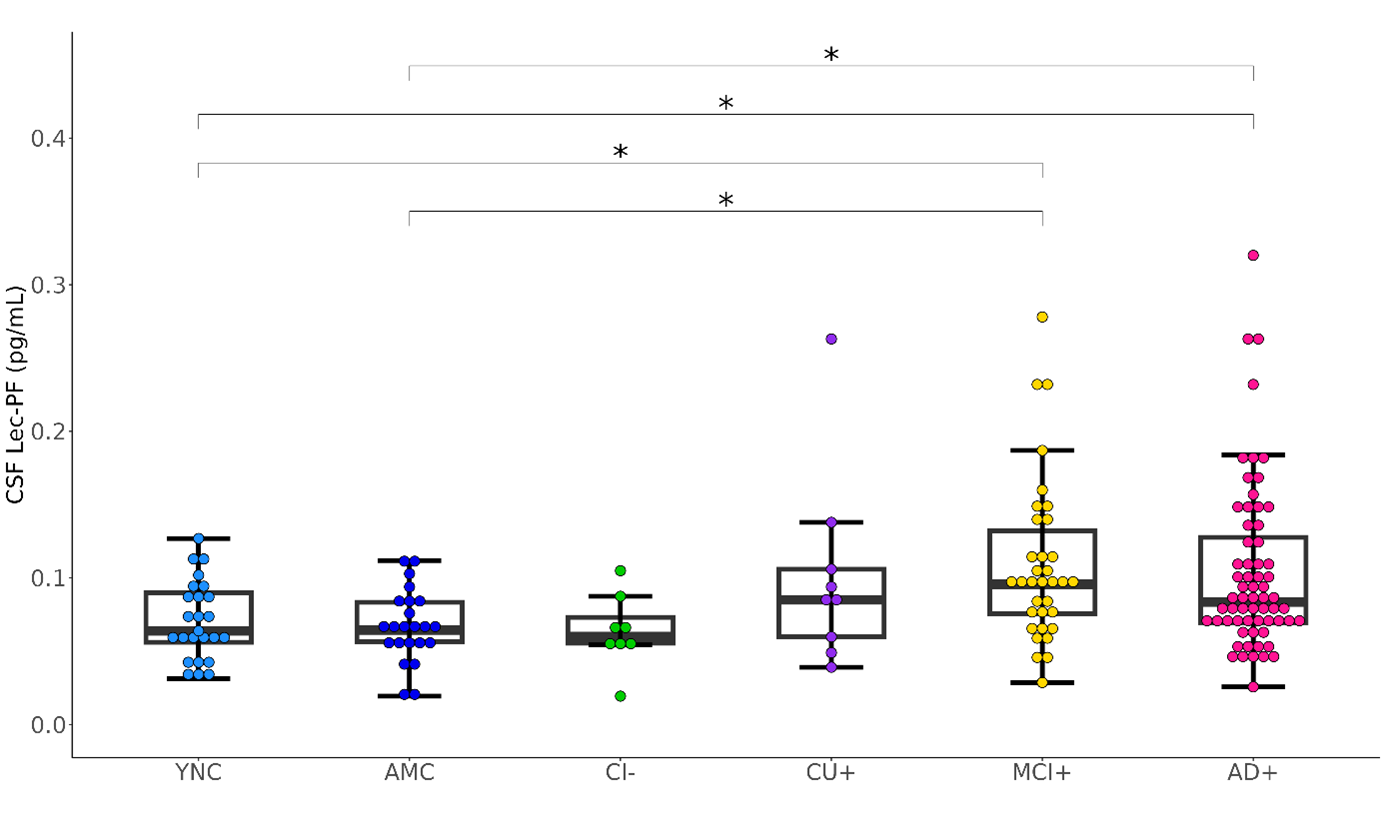
図1 臨床診断およびアミロイド陽性/陰性による脳脊髄液中のレカネマブ関連アミロイドβプロトフィブリル(CSF Lec-PF)濃度
箱ひげ図のボックスは四分位範囲、水平線は中央値を示しています。
各群の略語:YNC (アミロイド陰性若年正常対照群)、 AMC (アミロイド陰性同年代対照群)、CI- (アミロイド陰性認知機能低下群)、CU+ (アミロイド陽性認知機能正常群)、MCI+ (アミロイド陽性軽度認知障害群)、AD+ (アミロイド陽性アルツハイマー型認知症群)、CSF (脳脊髄液)
*p < 0.05
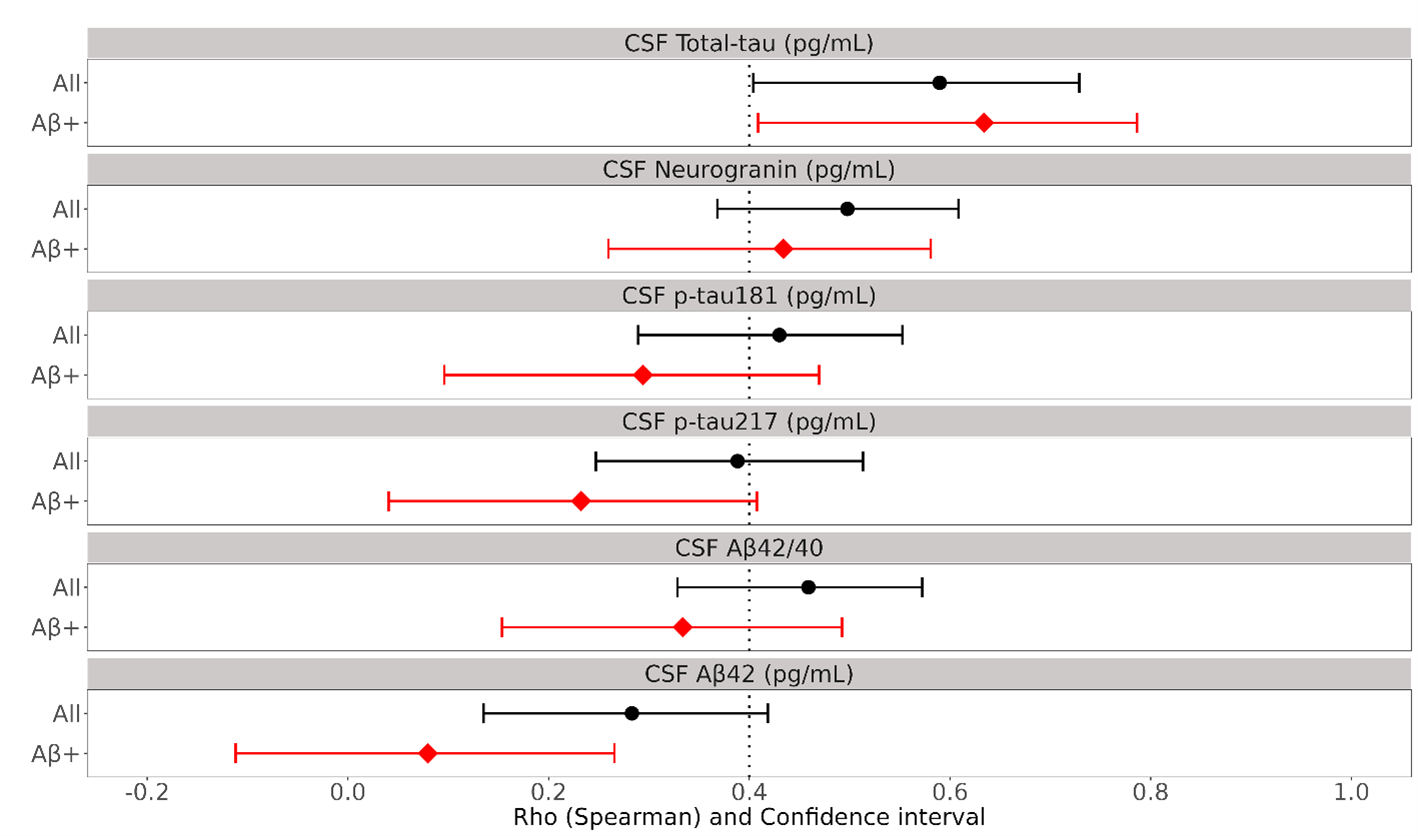
図2 脳脊髄液マーカーと脳脊髄液中のレカネマブ関連アミロイドβプロトフィブリル(CSF Lec-PF)の相関
黒線は被験者全体(アミロイドβ陽性と陰性の両方を含む)、赤線はアミロイド陽性群における各脳脊髄液マーカーとCSF Lec-PFのSpearmanの相関係数の95%信頼性区間(Confidence Interval: CI)、黒点、赤点は中央値を示しています。Spearmanの相関係数は、2つの変数間の順位相関の強さを示す統計学的な指標です。黒線と赤線の乖離が大きい場合は、Aβ陽性であるか陰性であるかが大きく寄与していることを示します。
今回の解析では、被験者全体(黒線)においては、CSF Lec-PFと、Aβ42、Aβ42/40比、p-tau 181、p-tau 217、total-tau、ニューログラニンの相関係数はすべて0.2以上であり、測定した全てのバイオマーカーとの有意な相関が認められました。
アミロイド陽性群(赤線)においては、神経変性のバイオマーカーであるCSF total-tauとCSFニューログラニンのSpearmanの相関係数はそれぞれ0.634(CI: 0.409-0.786)、0.434(CI: 0.260- 0.581)であり、CSF Lec-PFと2つのバイオマーカーに強い相関があることを示しています。一方、Lec-PFと脳内Aβの蓄積を示すバイオマーカーであるCSF Aβ42やCSF Aβ42/40比との相関は相対的に強くありません。このことは、CSF中のLec-PF 量は、脳内Aβ蓄積量よりも神経変性と強い関連があることを示しています。【掲載論文】
雑誌名:Annals of Neurology
論文名:Lecanemab-associated amyloid-β protofibril in cerebrospinal fluid correlates with biomarkers of neurodegeneration in Alzheimer’s disease
(アルツハイマー病において脳脊髄液レカネマブ関連アミロイドプロトフィブリル濃度は神経変性バイオマーカーとよく相関する)
著者名:Moeko Noguchi-Shinohara, Kazuyoshi Shuta, Hidetomo Murakami, Yukiko Mori, Junji Komatsu, Chizuru Kobayashi, Steven Hersch, Kanta Horie, Kenjiro Ono
(篠原もえ子、集田和好、村上秀友、森友紀子、小松潤史、小林千鶴、スティーブン ハーシュ、堀江勘太、小野賢二郎)
掲載日:2025年1月6日(米国東海岸標準時間)
DOI:10.1002/ANA.27175
【用語解説】
※1 レカネマブ
レカネマブは早期アルツハイマー病の治療薬で、アミロイドβ凝集体の中でも、神経毒性が特に高いとされるアミロイドβプロトフィブリルに選択的に結合する抗体です。2023年9月、日本において「アルツハイマー病による軽度認知障害及び軽度の認知症の進行抑制」の効能・効果で承認されました。
※2 プロトフィブリル
プロトフィブリルは、75-5000kDaの可溶性Aβ凝集体で、アルツハイマー病による脳損傷に寄与し、この進行性の深刻な疾患の認知機能低下に主な役割を果たす、最も毒性が高いAβ種であると考えられています。プロトフィブリルは脳内の神経細胞の損傷を引き起こし、その結果、複数のメカニズムを介して認知機能に悪影響を及ぼす可能性があります。
※3 アルツハイマー病
アルツハイマー病は徐々に進行する脳の疾患で、記憶や思考する能力が徐々に障害され、やがて日常生活に支障をきたす認知症と呼ばれる状態に陥る病気です。アルツハイマー病の患者さんの脳内には、アミロイドβという物質が溜まってできる老人斑といわれる構造物や、異常な神経線維のもつれ(タウタンパクが異常リン酸化して生じる神経原線維変化)、神経細胞の消失といった変化が見られ、これらの変化が長い時間をかけて進行します。
※4 総タウ
タウタンパクは、微小管結合タンパク質の一種で、中枢神経系および末梢神経系の神経細胞やグリア細胞に多く存在しています。アルツハイマー病を含む神経変性疾患では、病態の進行に伴い、脳脊髄液中総タウ(total-tau)濃度が上昇し、total-tauは神経変性マーカーとして用いられています。
※5 ニューログラニン
ニューログラニンは、ニューロン特異性シナプス後タンパクであり、脳皮質と海馬などの部位に多く存在します。特に、脳脊髄液中ニューログラニンは神経変性マーカーとして用いられています。
※6 アミロイドβ(Aβ)
アミロイド前駆体タンパク(amyloid precursor protein:APP)からβセクレターゼとγセクレターゼにより切断されて生じるペプチドで、C末端が40位で終わるAβ40、C末端が42位で終わるAβ42などがあります。特に、Aβ42は凝集性が高く、アルツハイマー病では、脳脊髄液Aβ42濃度の低下、Aβ40/42比の上昇がみられ、アミロイドPETによるアミロイド蓄積量と強い相関を示すことが知られています。
※7 プレクリニカルアルツハイマー病
認知機能障害が出ていない段階のアルツハイマー病です。
※8 SNAP(suspected non-Alzheimer’s disease pathophysiology:非アルツハイマー病の病態生理の疑い)
SNAPは、アミロイドPETや脳脊髄液Aβ40/42比、脳脊髄液Aβ42濃度は正常レベルにもかかわらず、アルツハイマー病類似の神経変性がみられる病態です。本研究では、図1のCI-群(アミロイド陰性認知機能低下群)がSNAPに該当します。
※9 リン酸化タウ
アルツハイマー病の病理所見である神経原線維変化は、過剰にリン酸化されたタウタンパク凝集体の蓄積が原因と考えられています。タウタンパクには、多くのリン酸化部位が知られています。特に、181番目のスレオニン残基がリン酸化されたタウタンパク(p-tau 181)や217番目のスレオニン残基がリン酸化されたタウタンパク(p-tau 217)は、アルツハイマー病でよく見られます。そのため、脳脊髄液中p-tau 181やp-tau 217がアルツハイマー病バイオマーカーとして使用されています。
【参考文献】
Amin L, Harris DA. Aβ receptors specifically recognize molecular features displayed by fibril ends and neurotoxic oligomers. Nat Commun. 2021;12:3451. DOI:10.1038/s41467-021-23507-z
【本件に関するお問い合わせ先】
■研究内容に関すること
金沢大学医薬保健研究域医学系
教授 小野 賢二郎(おの けんじろう)
TEL:076-265-2292
E-mail:onoken@med.kanazawa-u.ac.jp
准教授 篠原 もえ子(しのはら もえこ)
TEL:076-265-2292
E-mail:m-nohara@med.kanazawa-u.ac.jp
エーザイ株式会社
堀江 勘太(ほりえ かんた)
E-mail:kanta_horie@eisai.com
■広報担当
金沢大学医薬保健系事務部総務課総務係
山田 里奈(やまだ りな)
TEL:076-265-2109
E-mail:t-isomu@adm.kanazawa-u.ac.jp
エーザイ株式会社 PR部
TEL:03-3817-5120
