- 印刷用
- 2013年1月8日
ノーベルファーマ株式会社
エーザイ株式会社
-
ノーベルファーマ株式会社(本社:東京都、社長:塩村仁、以下「ノーベルファーマ」)とエーザイ株式会社(本社:東京都、社長:内藤晴夫、以下「エーザイ」)は、1月9日、抗悪性腫瘍剤「ギリアデル®脳内留置用剤 7.7mg」(一般名:カルムスチン、以下「本剤」)を新発売します。
本剤は、国内において、両社によるライセンス契約に基づき、ノーベルファーマが臨床試験を実施し、2012年9月28日に製造販売承認を取得し、同年11月22日に薬価収載されました。本剤の販売はエーザイが、プロモーションについては両社が共同で行います。
本剤は、ニトロソウレア系アルキル化剤であるカルムスチンを生体内分解性のポリマー基剤に含んだ、国内で唯一の脳内留置用の徐放性製剤です。悪性神経膠腫の切除術後の残存腫瘍近辺に、本剤を留置することにより、術直後から腫瘍細胞に直接、高濃度の抗悪性腫瘍剤を一定期間にわたり効率よく曝露させるため、術後療法(放射線療法、化学療法など)開始までの治療空白期を埋めることができ、残存腫瘍縮小や増殖抑制効果を発揮することが期待できます。海外で実施された臨床第Ⅲ相試験において、本剤の投与により、プラセボに比べて、初発悪性神経膠腫患者様では全生存期間が有意に延長され、再発膠芽腫患者様では6ヵ月生存率が有意に上昇しました。また、国内で実施された臨床試験においても、初発悪性神経膠腫患者様及び再発膠芽腫患者様に対して、本剤の良好な抗腫瘍効果と安全性プロファイルが確認されました。本剤は現在、米国や欧州、東南アジアを中心に世界30カ国で承認されています。
神経膠腫は脳に発生する腫瘍で、原発性脳腫瘍の約30%を占めています。日本における悪性神経膠腫の年間発症数は、約2,000~2,500人と推定されています。日本では、本剤は、2008年9月の未承認薬使用問題検討会議で医療上の必要性が指摘され、2009年6月には希少疾病用医薬品(オーファンドラッグ)として指定されています。
悪性神経膠腫は未だ治療が困難な疾患であり、本剤が悪性神経膠腫に苦しむ患者様にとって新たな治療オプションとなることを期待しています。なお、承認条件に従い、製造販売後一定の症例数に達するまでの間、投与された全ての患者様を対象に使用成績調査(全例調査)を実施し、本剤の有効かつ安全な適正使用を推進してまいります。
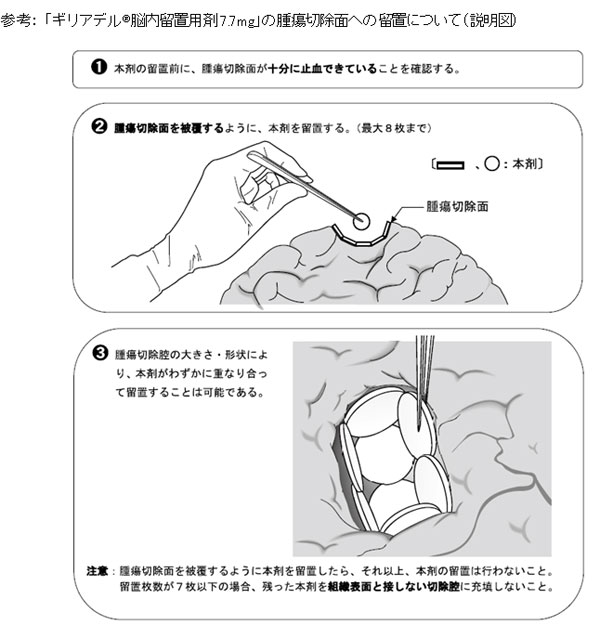
[参考資料として、「ギリアデル®脳内留置用剤7.7mg」の製品概要、神経膠腫、臨床試験について、
製品写真、腫瘍切除面への留置について(説明図)を添付しています]
本件に関する問い合わせ先
-
ノーベル ファーマ株式会社
経営企画部
-
エーザイ株式会社
PR部
<参考資料>
1. 製品概要
| 1) 製品名 | : ギリアデル®脳内留置用剤 7.7mg |
| 2) 一般名 | : カルムスチン |
| 3) 効能・効果 | : 悪性神経膠腫 |
| 4) 用法・用量 | : 通常、成人には、脳腫瘍切除腔の大きさや形状に応じて、本剤8枚(カルムスチンとして61.6mg) 又は適宜減じた枚数を腫瘍切除術時の切除面を被覆するように留置する。 |
| 5) 薬価 | : 7.7mg 1枚 156,442.60円 |
| 6) 包装 | : ギリアデル®脳内留置用剤 7.7mg 8枚(分包1枚 × 8) |
| 7) 製造販売元 | : ノーベルファーマ株式会社 |
| 8) 販売元 | : エーザイ株式会社 |
2. 神経膠腫(しんけいこうしゅ)について
神経膠腫は、脳腫瘍のうち、脳実質内に存在するグリア細胞由来の原発性腫瘍の総称で、その多くは予後不良な悪性の腫瘍です。神経膠腫は原発性脳腫瘍の約30%を占め、多くは脳内・脊髄内に拡がって発育(浸潤)することが特徴で、腫瘍の境界が不鮮明であり、周辺部では正常脳組織と腫瘍細胞が混在し手術による全摘出が困難であるため、悪性の神経膠腫の5年生存率は25%以下と予後不良の腫瘍です。
神経膠腫の標準的治療として、通常、外科的手術(開頭手術)が行われ、多くの場合、術後に放射線治療や化学療法が行われます。しかし、化学療法剤の全身投与では、有効成分が血液脳関門により腫瘍部位では有効濃度まで十分に到達せず、全身的副作用のため十分量の化学療法剤を投与できないこともまた悪性神経膠腫の予後が悪い理由のひとつに挙げられます。
3. 国内臨床試験(NPC-08-01)について
本剤の有効性及び安全性を評価する目的で、初発悪性神経膠腫患者様(以下「初発患者」)16 例及び再発膠芽腫患者様(以下「再発患者」)8 例を対象に実施された多施設共同、非対照、非盲検試験です。腫瘍切除術時、切除腔に本剤を最大8枚留置し、留置後14日以降、初発患者にはテモゾロミド、放射線療法、再発患者にはテモゾロミドを主とした適切な治療を併用し、本剤留置後6、12ヵ月時点の生存率、安全性を評価しました。初発 患者の12 ヵ月生存率は100.0%(16/16例)で、再発患者の6ヵ月生存率は87.5%(7/8例)、12 ヵ月生存率は62.5%(5/8例)でした。
なお、副作用(臨床検査値異常を含む)発現症例は54.2%(13/24例)で、主な副作用は、脳浮腫25.0%(6/24例)、発熱12.5%(3/24例)、リンパ球数減少12.5%(3/24例)、片麻痺(不全片麻痺を含む)12.5%(3/24例)、悪心8.3%(2/24例)、嘔吐8.3%(2/24例)、食欲減退8.3%(2/24例)、頭痛8.3%(2/24例)、ALT(GPT) 増加8.3%(2/24例)でした。
4. 海外臨床第Ⅲ相試験について
本剤の有効性及び安全性を初発患者240 例を対象として、プラセボと比較検討した多施設共同、無作為化、二重盲検、プラセボ対照試験(T-301 試験)では、全生存期間の中央値は、本剤群13.9ヵ月、プラセボ群11.6ヵ月で、本剤群で有意な延長が認められました(p=0.03)。副作用発現率は、本剤群55.8%(67/120例)、プラセボ群60.8%(73/120例)でした。また、再発患者222 例を対象にした多施設共同、無作為化、二重盲検、プラセボ対照比較試験(8802試験)では、6 ヵ月生存率は、本剤群60.0%、プラセボ群47.3%(p=0.06)、全生存期間の中央値は、本剤群7.24ヵ月、プラセボ群5.42ヵ月でした(p=0.30)。しかし、膠芽腫患者145例のみを対象とした解析では、6 ヵ月生存率は、本剤群55.6%、プラセボ群35.6%で、有意な差があり(p=0.02)、全生存期間の中央値は、本剤群6.4ヵ月、プラセボ群4.6ヵ月でした。副作用発現率は、本剤群60.9%(67/110例)、プラセボ群63.4%(71/112例)でした。
[製品写真]