- 印刷用
- 2012年7月19日
エーザイ株式会社(本社:東京都、社長:内藤晴夫)は、当社が創製し、アルツハイマー型認知症治療剤として開発中のβサイト切断酵素(BACE)阻害剤「E2609」に関する初めての臨床試験結果について、国際アルツハイマー病学会2012(Alzheimer's Association International Conference: AAIC)にて口頭発表しましたので、お知らせします。
βアミロイドの脳内の沈着はアルツハイマー型認知症の病因の一つと考えられており、βアミロイドを減少させることにより、症状改善だけでなく病態の進行を抑制するなどの疾患修飾作用を有する新たなアルツハイマー型認知症治療剤の開発が期待されています。「E2609」は、アミロイド前駆体タンパク質のβサイト切断酵素であるBACEを阻害することでβアミロイドの総量を低下させます。今回発表した「E2609」に関する2つのフェーズI試験は、経口投与による単回投与用量漸増試験(A001-001試験)および14日間の投与による反復投与用量漸増試験(A001-002試験)であり、A001-001試験では血漿中のβアミロイド量が減少すること、またA001-002試験では脳脊髄液中への本剤の移行量が用量依存的に増加するとともに、脳脊髄液中βアミロイドが統計的に有意に減少することを確認しました。この結果により、ヒトにおいても本剤のBACE阻害作用によりβアミロイドの産生が抑えられるという「Proof of Mechanism」が証明されました。
A001-001試験は、73名の健康成人を対象とした無作為化プラセボ対照、二重盲検、単回投与用量漸増試験で、5mgから800mgまで9つの投与量群に分けて、投与前と投与後144時間後までの血漿中のβアミロイド(Aβ1-x)レベルを測定しました。投与前と比較した血漿中のAβ1-xの減少率は、5mg投与群で最大52%、800mg投与群で最大92%に達しました。また、800mgまでのすべての投与量群において良好な忍容性を示し、主な副作用は頭痛およびめまいでした。
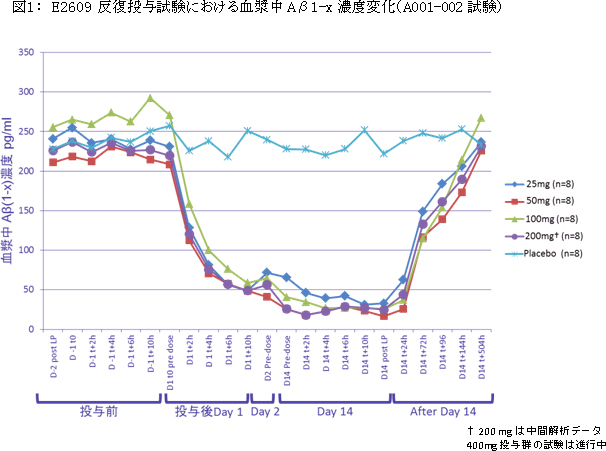
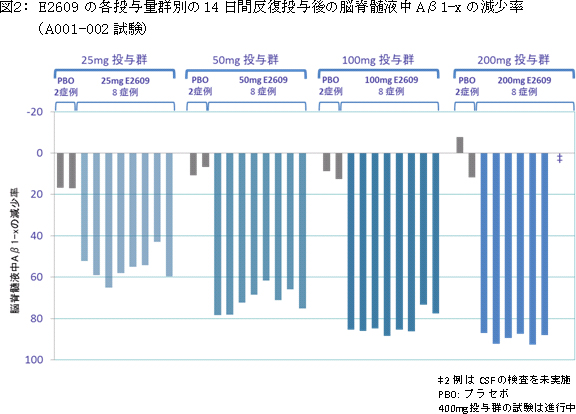
A001-002試験は、50名の健康成人を対象とした無作為化プラセボ対照、二重盲検の14日間の反復投与用量漸増試験で、25mg/日から400mg/日までの5つの投与量群に分けて、血漿中および脳脊髄液中のAβ1-xレベルの測定を行いました。本試験の中間予備解析結果によると、E2609は、25mg/日から200mg/日までの投与量群において、血漿中のAβ1-xが顕著に減少し(図1参照)、さらに用量依存的に脳脊髄液中のAβ1-xが減少しました(図2参照)。投与前と投与14日後の脳脊髄液中のAβ1-xの減少率のプラセボとの差異は、25、50、100、200mg/日でそれぞれ、46.2%、61.9%、73.8%、79.9%であり、統計学的に有意な減少を示しました。200mgまでの投与群においては重大な安全性に関する懸念は認められませんでした。なお、200mg投与群で見られた口唇ヘルペスの再発に関しては評価中であり、薬剤との因果関係は不明です。
当社は、アルツハイマー型認知症治療薬「アリセプト®」を発売して以来、剤形や効能・効果の追加や早期診断、早期治療に向けた疾患啓発、診断技術の向上などにより、患者様にとっての価値創造に取り組んでいます。しかし、アルツハイマー型認知症においては、今なお多くのアンメット・メディカルニーズが存在しています。当社は、次世代アルツハイマー型認知症治療剤の開発をめざし、「E2609」に加え、Aβプロトフィブリルに対する新規モノクローナル抗体「BAN2401」などの開発を進め、アルツハイマー型認知症患者様とそのご家族の多様なニーズの充足とベネフィット向上に、より一層貢献してまいります。
以上