- 印刷用
- 2007年11月29日
エーザイ株式会社(本社:東京都、社長:内藤晴夫)は、本日、国内で開発を進めていました肥満症治療剤KES524(一般名:シブトラミン塩酸塩水和物)について製造販売承認の申請を行いました。
本剤は、セロトニンおよびノルアドレナリン再取り込み阻害作用に基づく肥満症治療剤であり、世界83カ国で承認されています。国内では、アボット社との契約により、当社が独占的な開発・販売権を有しています。
国内で実施したフェーズⅢ試験は、肥満症患者様342名を対象とし、KES524投与群とプラセボ投与群による52週間を治療期間とした、多施設、無作為化二重盲検比較試験です。その結果、主要評価項目である体重変化量および体重変化率、その他の副次評価項目である内臓脂肪面積などにおいて、KES524投与群はプラセボ投与群と比較して有意な改善を示しました。主な副作用としては、便秘、口内乾燥、心拍数増加等がみられましたが、ほとんどが軽度または中等度であり、これまでの国内外試験の結果と大きな差異はありませんでした。
欧米と同様、日本でも肥満症や近年注目されているメタボリックシンドローム等における疾病管理の重要性が高まる中、当社は、肥満症の疾病管理に資する新たな治療剤を提供することで患者様のベネフィット向上に貢献してまいります。
以上
[参考資料として、国内フェーズⅢ試験の概要と結果について添付しています]
<参考資料>
■国内フェーズⅢ二重盲検比較試験の概要と結果
1.概要
※左右にスクロールできます
| 対象: | 肥満症342症例(各群171例) |
| 主な選択基準: | BMI≧25kg/m²、内臓脂肪面積(VFA)≧100cm² 2型糖尿病と診断され 6.1%≦HbA1C<9.0% 脂質代謝異常(TG≧150 mg/dL and/or HDL-C<40 mg/dL) |
| 投与期間: | 観察期4週間、治療期52週間、フォローアップ期12週間 |
| 投与群: | KES524(10mg/日、効果不十分の場合15mg/日に増量)およびプラセボ |
| 主要評価項目: | 体重変化量(kg)および体重変化率(%) |
| 副次評価項目: | 内臓脂肪面積(VFA)、HbA1C(ヘモグロビンA1C)、 TG(トリグリセライド)、HDL-C(HDLコレステロール) など |
2.結果
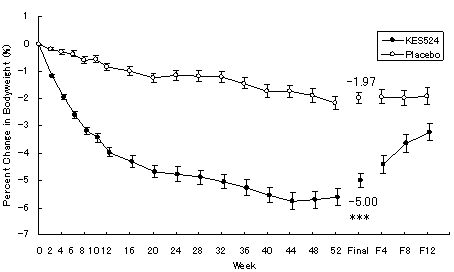
主要評価項目の体重変化率(下図)は、本剤群で-5.00%であり、プラセボ群の-1.97%と比較して有意に減少した。もう1つの主要評価項目である体重変化量(kg)についてもプラセボ群と比較して有意に減少した。また、本剤投与により、腹部CTによる内臓脂肪面積(VFA)がプラセボ群と比較して有意に減少した。更に、本剤投与による体重減少に伴い、HbA1C、トリグリセライドおよびHDLコレステロールがプラセボ群と比較して有意に改善した。主な副作用としては、便秘、口内乾燥、心拍数増加等がみられたが、副作用のほとんどは軽度又は中等度であり、安全性に関してこれまでの国内外試験の結果と大きな差異はなかった。