- 印刷用
- 2014年5月12日
エーザイ株式会社(本社:東京、社長:内藤晴夫)は、このたび、ドイツ医薬品販売会社であるエーザイ・ゲーエムベーハ(所在地:フランクフルト)が、ファーストインクラスの抗てんかん剤「Fycompa®」(AMPA受容体拮抗剤、一般名:ペランパネル)について、追加有用性再評価の申請をドイツ連邦合同委員会(G-BA)に対して提出しましたのでお知らせします。本剤に関する追加有用性再評価の結果は、6ヵ月以内に公表される予定です。
本剤は、2012年9月にドイツで発売以来、3,000~4,000人の患者様に使用されています。当社は、2013年3月のG-BAによる追加有用性評価において本剤の有用性ならびに革新性が適切に認められなかったことを受け、ドイツでの本剤の販売を一時中断するとともに、本剤による治療を必要とされている患者様には、継続的に治療を受けられるよう、個別の輸入による無償の患者様支援プログラムで本剤を提供してきました。一方、追加有用性評価の制度が一部改正されたことに伴い、2014年2月にG-BAは本剤の早期再申請を認める決定をしていました。
ドイツには200人に1人、約40万人のてんかん患者様がいると推定されています。部分てんかん発作の抑制は難しく、3割以上の患者様は、既存の抗てんかん剤による適切な治療にも関わらず、発作を十分にコントロールできておらず、革新的新薬が強く望まれています。本剤は、12歳以上のてんかん患者様の部分発作(二次性全般化発作を含む)に対する併用療法として、欧州、北米、アジアの35カ国以上で承認されています。
当社は、今回の追加有用性再評価において、本剤の有用性ならびに革新性が適切に認められ、ドイツでの本剤の販売を再開し、部分てんかん患者様のもとに確実にお届けできるようになることを期待しております。
以上
[参考資料として、Fycompa®、用語解説を添付しています]
<参考資料>
1.「Fycompa®」(ペランパネル)について
「Fycompa®」(ペランパネル)は、当社が創製した新規化合物であり、AMPA受容体に対して非競合的な拮抗剤です。本剤は、シナプス後AMPA受容体のグルタミン酸による活性化を阻害し、神経の過興奮を抑制することで、抗てんかん作用を発揮すると考えられています。本剤は、部分てんかんを対象とした臨床第Ⅱ相および第Ⅲ相試験において、発作抑制効果が示されています。本剤は、1日1回の経口投与の部分てんかん治療剤として、欧州並びに米国で承認を取得、および日本・中国・アジアでは臨床第Ⅲ相試験の段階にあります。さらなる適応の拡大をめざし、全般てんかんについて国際共同治験として臨床第Ⅲ相試験を、部分てんかんの小児患者様を対象に欧米で臨床第Ⅱ相試験を実施しています。
2. 用語解説
- 1)ドイツ連邦合同委員会(G-BA)
医師、歯科医師、病院および疾病金庫からなる独立したドイツにおける医療制度の最高意思決定機関であり、医薬品をはじめとする医療サービスに関する保険償還などについての決定権を有しています。
- 2)G-BAによる追加有用性評価について
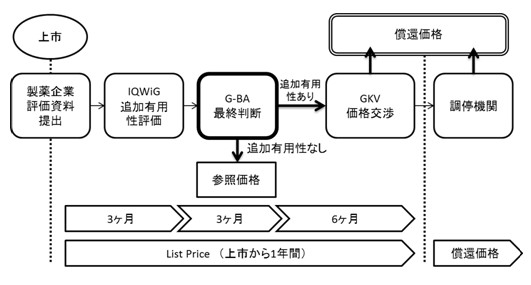
2011年1月に施行された医薬品市場再編法(AMNOG)により、ドイツで発売された全ての新薬は、G-BAによる追加有用性評価を受けることが義務付けられ、この評価に基づく価格交渉を経て、発売後1年以内に償還価格が決定されることになりました。
新製品上市に際して、製薬企業は比較治療薬に対して追加的な有用性を示した提出書類(benefit dossier)を提出する必要があります。提出された資料は、G-BAからの委託を受けたIQWiGにより比較治療薬に対する追加有用性があるか評価され、公表されます。製薬企業に対して、本評価に対するヒアリングによるコメントの機会が与えられた後、G-BAが当該薬剤に対する有用性評価に対する最終判断を行います。
G‐BAによる追加有用性が認められた場合には、公的医療保険協会(GKV-SV)との価格交渉段階に進み、G-BAによって設定された有用性レベルに基づき償還価格が決定されます。一方、追加有用性が認められないと判断された薬剤には、原則参照価格が適応され、評価で用いられた比較治療薬と同レベルの価格に設定されます。