方針
「我々の造る一錠、一カプセル、一管が患者様の命とつながっている」
これはエーザイが掲げる品質方針であり、私たちがお届けする医薬品の一つひとつが患者様・生活者の皆様の生命に直結しているという認識を社員一人ひとりが持ち、生産活動に取り組んでいることを示しています。世界各地で私たちが製造する医薬品を待つ患者様・生活者の皆様がいる限り、高品質な医薬品を安定供給しつづける使命と責任があり、その目的を達成するために、エーザイは、原薬研究・製剤研究から生産、流通までのすべてのプロセスにおいて万全の体制で品質確保に努めています。
目標・アクション
医薬品の品質保証の範囲は、医薬品がそれを必要とする患者様・生活者の皆様のお手元に届けられ実際に使用されるところにまで及んでいます。
エーザイでは、各国で求められる規制・基準や承認書への適合はもちろんのこと、患者様・生活者の皆様の潜在的な欲求・期待に応える顧客品質の追究と実現を重要課題と捉えています。自社工場、製造委託先を問わずすべての製造所で製造した医薬品を同一水準の品質でお届けし、世界のいかなる国と地域においても安心してご使用いただけるよう、日々のオペレーションに取り組んでいます。
グローバルな品質部門体制のもと、統一されたGMP (Good Manufacturing Practice: 製造管理および品質管理に関する基準)に準拠した製造・品質管理活動と同時に、製造現場で作り上げた品質そのままに患者様・生活者の皆様へお届けするべく、GDP (Good Distribution Practice: 医薬品の適正流通)に準拠した品質確保にも注力しています。特に、医薬品の品質保証には欠かせないデータの信頼性確保のためのデータインテグリティ(データの完全性、一貫性、正確性)の強化や、複雑化するサプライチェーンにおいても医薬品品質を管理するためのGDPなどについては、グローバルプロジェクトチームでエーザイとしての考え方や対応方法の議論を進めています。
また、新薬申請前の早い段階からの上市に向けた開発活動への積極的な関与、さらに承認後の法令順守のための申請内容との整合性確認など、研究開発部門との連携を一層に強化することによる、開発から商業生産へのスムーズな移行も、注力している点のひとつです。医薬品を待ち望んでおられる患者様・生活者の皆様へ少しでも早くお届けするために、これらの活動を通して、社会善の実現に貢献しています。
体制
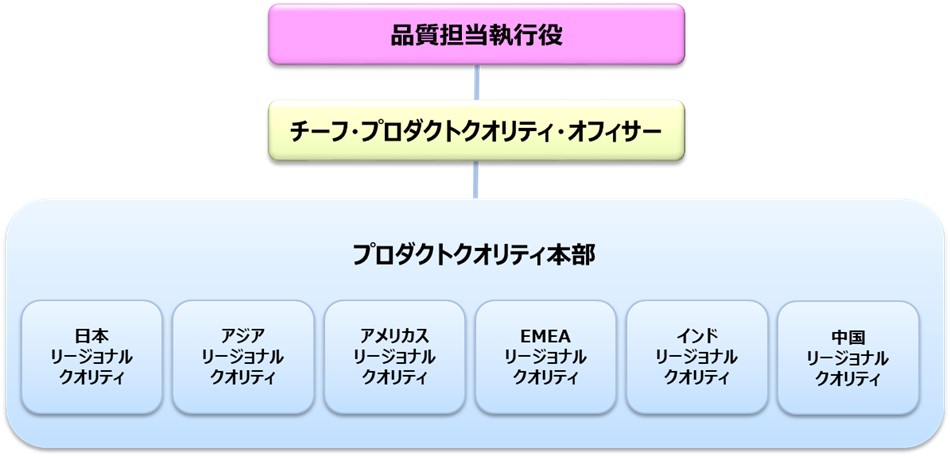
エーザイでは、医薬品の品質保証の責任を有する品質担当執行役のもとに、チーフ・プロダクトクオリティ・オフィサーを任命し、全世界で市販される当社製品の品質を保証する責任体制を構築しています。品質保証体制の中心は、プロダクトクオリティ本部の本部長の元、日本、アジア、アメリカス、EMEA(Europe, Middle East and Africa)、インド、中国の6地域のリージョナルクオリティ責任者で構成されるグローバル製品品質委員会(Global Product Quality Committee: GPQC)が担っています。
GPQCでは、各リージョンから品質関連情報やグローバルに影響を及ぼす薬制情報を収集し、それに対する検証や対応についてメンバーで協議し、意思決定を行っています。
また、日本国内および米国、英国、中国、インド、インドネシアの自社生産拠点の品質保証担当部署に加え、各国の自社販売会社においても品質担当者を任命し、販売国における苦情対応や承認事項の変更管理、万が一の場合の医薬品の回収手続きを実施するなど迅速な対応ができる体制を構築しています。
取り組み
エーザイでは、世界のいかなる国と地域においても、安心してご使用いただける品質を確保するシステムを構築しています。
製造所の管理
自社の各製造所では、共通のKPI (Key Performance Indicators: 重要評価基準)を適用し、品質事象に対し、グローバルに一貫した方針の基、是正・予防措置を水平展開することにより、継続的な評価および改善を図っています。
委託先に対しても、自社の製造所や管理する委託先で起こった品質事象について、共有し、同様事象の発生を未然に防ぐ取り組みを行っています。また、定期的なGMP監査による品質マネジメントシステムの点検や、委託先管理のためのKPIを定めて、継続的な評価と向上に努めています。
データの信頼性
製薬企業にとって、研究データや生産データ等のインテグリティの確保は、製品の安全性や信頼性の根拠となるため極めて重要です。データインテグリティが確保できない場合、新薬開発の遅延・中止や、製品の回収、販売停止など、患者様や生活者の皆様に重要な影響を及ぼす可能性があり、社の業績のみならず信用を失う事態を招き得ます。
医薬品を製造、検査する上でのデータインテグリティの確保とさらなる強化のために、GMP遵守の重要性や当社の企業理念に相応しい行動について定期的な研修を実施し、下意上達の組織文化、風通しの良い職場風土の醸成に努めています。また、製造と品質を執り行なうガバナンスを分離することで、チェック体制を整備しています。製造委託先でのデータインテグリティ確保の強化としては、実際のデータ取得・記録方法の確認を定期監査の項目のひとつに掲げ、できる限り実地での監査実施に取り組んでいます。
加えて、自社工場においては特に、重要データの算出や記録の機械化・自動化によるデータインテグリティの確保とともに、遠隔化等も実現する次世代型工場への転換もめざした活動を推進しています。
承認事項への適合性確保
医薬品は、各国の規制要件に合致させることはもちろん、承認された方法に従い製造および検査され、企図する品質が保証されてはじめて、必要とする患者様にお届けすることが可能となります。当社では、定期的な承認書との整合性を確認するとともに、品質管理・品質保証システムの継続的な自己点検、他社の品質事例を踏まえたリスクアセスメントを実施し、品質事象が発生した場合においても、それを確実に検知する品質保証システムの構築と、その改善に努めています。加えて、製造所における商業化のための準備(製造・分析手順等)が申請内容に即したものとなっていることを、申請前段階で確認するなど、研究開発部門との連携を一層に強化することにより、適切な製造・分析方法を標準化した手順書とし、商業生産へのスムーズな移行と承認後の早期の上市への寄与に努めています。
偽造医薬品への対応
医薬品の開発ならびに流通のグローバル化が著しく加速する中、偽造医薬品のリスクが開発途上国や新興国にとどまらず、先進国においても高まっていることが報告されています。エーザイでは、通常の品質保証活動に加えて医薬品が安全かつ確実に患者様のお手元に渡るよう、専門の組織によるグローバルなプロダクトセキュリティー活動を推進しています。規制当局、業界他社および業界団体と連携して偽造医薬品・違法流通の監視や発生防止対策に積極的に取り組み、具体的な事例が検知された場合にはプロダクトセキュリティー執行委員会を中心に、調査、法的措置、安定供給の確保など、迅速な対応を図ります。近年増加しているソーシャルメディアを通じた偽造医薬品の流通へも適切な対応を講じてきています。
また、偽造医薬品や違法な流通を経た医薬品が医療現場に提供されることを防止するためには、医薬品流通の実態をより的確に把握し、医薬品の適正かつ安全な供給と使用をはかる必要があります。そのため、医薬品流通のトレーサビリティ(履歴管理)を確保する取り組みが世界各地で展開され、一部の国/地域ではすでに規制化されています。エーザイでは、特殊な包装材料や印刷技術を用いることによる疑似の困難化・検出の容易化、インターネットやソーシャルメディアを含む偽造品流通の監視、規制当局・製薬企業・医療現場による取り組みへの積極的な参加、さらには主に新興国における当局や各業界団体等に対するエーザイのプロダクトセキュリティー活動や製品に対する教育を行なっています。
